![]()
Actualización en el manejo de la pubertad

22
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
Revisiones y
Actualizaciones
Actualización en el manejo
de la pubertad
Gálvez Aguilar MI., López-Canti Morales L., Espino Aguilar R.
Unidad de Endocrinología Pediátrica. UGC Pediatría y Neonatología.
Hospital Universitario Ntra. Sra. de Valme (Sevilla).
Dir. Corresp.: Hospital Universitario Virgen de Valme. UGC de Pediatría y Neonatología.
Ctra. de Cádiz s/n 41014 Sevilla - doctora_galvez@hotmail.com
Recibido: 23-02-2012 Aceptado: 03-03-2012
Vox Paediatrica 2012; XIX(2):22-27
Introducción
L
a pubertad, etapa fundamental en el desarro-
llo humano, tiene una fisiología y cronología pro-
pias que determina cambios profundos tanto en
el plano físico como psicológico y conductual del ado-
lescente.
Característica fundamental es su gran variabilidad,
tanto en la forma de inicio como en la secuencia de
acontecimientos y duración total de los mismos. El co-
nocimiento de la “fisiología normal” de la pubertad
es prioritario para evitar diagnósticos erróneos y trata-
mientos que pueden resultar innecesarios
(1,2)
.
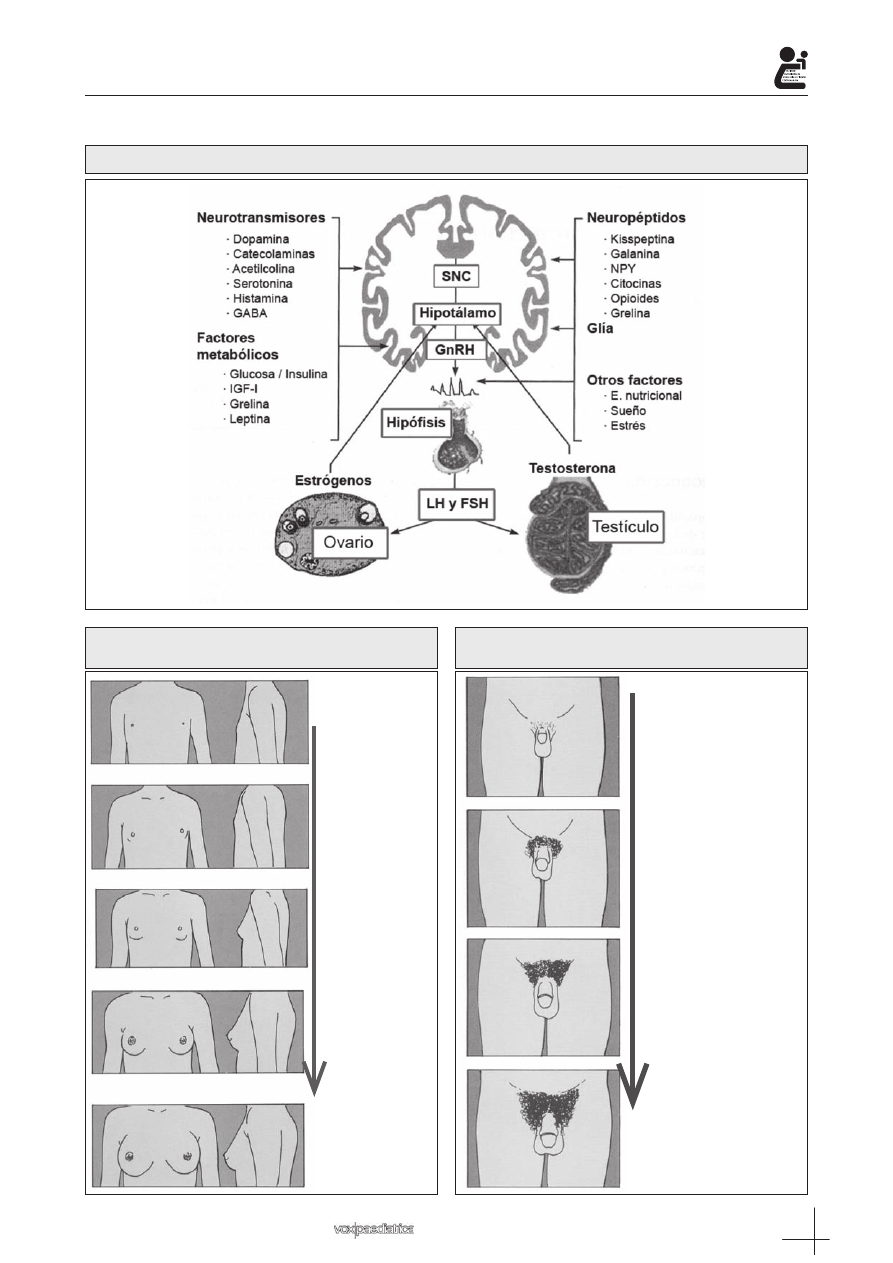
Los factores que determinan el inicio puberal y su
progresión son múltiples y complejos y abarcan desde
factores neuro-reguladores, como la propia GnRH, el
equilibrio entre señales excitatorias (kisspeptinas, ca-
tecolaminas) e inhibitorias (GABA, opioides) o las célu-
las gliales, a factores permisivos que informan al SNC
del estado de las reservas energéticas (leptina) todo
ello sin olvidar la importancia de los factores ambienta-
les como el nivel de desarrollo económico, geográfico,
contaminantes, sumados todos ellos a la genética indi-
vidual
(1,3,4,5,6)
(Figura 1).
Cronología de la pubertad normal y sus variantes
Para diagnosticar cualquier alteración en el desarro-
llo de la pubertad es fundamental conocer, en primer
lugar, qué es lo normal.
Se sabe que, a efectos prácticos en la clínica, el pri-
mer signo de pubertad en la mayoría de las niñas es la
aparición del botón mamario, lo que ocurre a una edad
ósea (EO) de unos 11 años, y para su correcta valo-
ración no es suficiente con la inspección sino que la
mama debe ser palpada, pues una adipomastia puede
sobreestimar el estadío puberal (Figura 2). Un dato a
destacar es que hasta en el 20% de las niñas el ve-
llo pubiano puede ser la primera manifestación de la
pubertad
(2)
. Otros cambios importantes durante la pu-
bertad femenina, que pueden ser valorados mediante
ecografía, son el aumento de tamaño del útero junto
al cambio en su morfología, visualizando en su interior
la línea endometrial, así como el crecimiento ovárico,
considerándose puberal un tamaño mayor de 1 ml y la
presencia de más de 6 folículos de más de 10 mm
(1,2)
.
Por último, dentro de la pubertad femenina el evento
fundamental es la menarquia, que suele aparecer entre
2 y 3 años después del inicio del desarrollo puberal. En
nuestro país la menarquia se produce a una edad me-
dia de 12.5 +/- 0.8 años
(1)
.
Por su parte, en los niños, el primer signo clínico de
pubertad es el aumento del tamaño testicular por en-
cima de 4 ml, que valoraremos igualmente por palpa-
ción y comparación usando el orquidómetro de Prader
(1,7)
(Figura 3). El resto de caracteres sexuales en el va-
rón (vello pubiano, axilar, facial) son de aparición más
tardía. Un hecho importante que hay que destacar en
la pubertad masculina es que hasta en el 60% de los
niños aparece un aumento del tamaño mamario, deno-
minado “ginecomastia puberal” producida por aro-
23
Volumen XIX Nº 2 Noviembre 2012
A
CTUALIZACIÓN
EN
EL
MANEJO
DE
LA
PUBERTAD
Figura 1.: Regulación neuroendocrina del eje hipotálamo-hipófiso-gonadal
S-I. Estado
infantil
S-II. Botón
mamario.
Ligero aumento
diámetro areola
S-III. Aspecto
mama adulta
pequeña
S-V. Corresponde
a mama adulta
S-IV. Continua
desarrollo
crecimiento
areola y pezón
Figura 2.: Estadíos de Tanner para el desarrollo
mamario. 1962
Figura 3.: Estadíos de Tanner para el desarrollo
testicular, escrotal y peneano. 1962
G-I. Estado infantil
G-IV. Prosigue aumento
de longitud y diámetro.
12-20 mL
G-V. Corresponde a
adulto. 20-25 mL
G-III. Aumento longitud
pene y diámetro.
6-12 mL
G-II. Aumento tamaño
testicular, pene y
escroto. 4-6 mL

24
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
matización periférica de los andrógenos en estrógenos.
Esto genera una gran preocupación en el adolescente,
pero en el 90% de los casos regresa en los siguientes
6-12 meses, y en el 10% restante puede estar justifi-
cada, en función de la evolución, la utilización de tra-
tamiento específico con antiestrógenos (Tamoxifeno) o
incluso cirugía
(1,7)
.
Dentro de la pubertad podemos encontrar algunas
variantes que se consideran normales y es importante
conocer para evitar diagnósticos y procedimientos
erróneos. En primer lugar la adrenarquia o pubarquia
precoz, es la aparición de vello pubiano en los niños
antes de los 9 años y en las niñas antes de los 8 años,
siendo más frecuente en éstas últimas. Se debe a la
activación precoz de las glándulas suprarrenales que
origina una mayor producción de andrógenos. En es-
tos casos es importante tener presente en el diagnós-
tico diferencial la hiperplasia suprarrenal congénita en
su forma no clásica
(8)
. Un dato a tener en cuenta es que
en el seguimiento postpuberal de estas pacientes se
ha visto una elevada incidencia de síndrome de ovárico
poliquístico, así como de hiperinsulinismo y un perfil li-
pídico aterogénico, ambos factores de riesgo para el
desarrollo de síndrome metabólico
(1)
. La segunda en-
tidad es la telarquia precoz aislada que es la apari-
ción del botón mamario en niñas antes de los 8 años,
sin acompañarse de otros signos de pubertad. Es muy
frecuente en las recién nacidas por aumento de los es-
trógenos de origen placentario, y durante el primer año
de vida posiblemente debido a la presencia de quistes
foliculares activos, o fuentes exógenas de estrógenos
(9)
. Es una entidad benigna que suele regresar espon-
táneamente
(1,10)
. Por último, la menarquia precoz ais-
lada, es un sangrado vaginal aislado en niñas de 1 a
9 años de edad, igualmente sin la presencia de otros
signos de pubertad. Esta variante es infrecuente y su
etiología desconocida. En la exploración es necesario
descartar alteraciones orgánicas como traumatismos,
abuso sexual, infecciones, tumores
(1,10)
. Todas estas
variantes son benignas y por lo general no precisan tra-
tamiento. No obstante, es conveniente un seguimiento
periódico en consulta hasta el inicio de la pubertad,
para vigilar que no se produzca una progresión hacia
una pubertad precoz verdadera.
Patología de la pubertad: pubertad precoz y retrasada
La mejora significativa de la calidad de vida es el
principal motivo del adelanto puberal que se ha venido
observando a lo largo del último siglo. Esto ha dado lu-
gar a controversias sobre la edad límite para considerar
la pubertad como precoz o no. En nuestro medio el lí-
mite se sitúa en los 8 años para las niñas y los 9 años
para los niños
(2,10,11,12,13)
. ¿Pero qué pasa con aquellos
niños que inician su desarrollo puberal en el límite infe-
rior considerado como normal, es decir, niñas entre los
8-9 años y niños entre 9-10?. Se habla entonces de
pubertad adelantada; son niños sanos que simple-
mente han iniciado la pubertad en el extremo precoz de
la curva de distribución normal de su población de re-
ferencia
(11)
. En ellos no está indicado realizar un estudio
hormonal, ni iniciar ningún tratamiento, solamente sería
conveniente realizar un seguimiento con medición de
talla y velocidad de crecimiento, para vigilar que no se
trate de una forma rápidamente progresiva de puber-
tad que posteriormente tenga una repercusión negativa
en la talla final esperada.
Dentro de la pubertad precoz se distinguen 3 en-
tidades: 1) Central o verdadera (PPC), 2) Periférica o
pseudopubertad precoz (PPP), 3) Mixta (activación eje
hipotálamo-hipofiso-gonadal (HHG) secundaria a una
PPP) (Tabla I)
(11)
.
La PPC se debe a la activación precoz del eje HHG,
caracterizándose clínicamente por la aparición precoz
de los caracteres sexuales secundarios siguiendo la
misma secuencia que en la pubertad normal, por lo que
siempre va a ser acorde con el sexo del paciente, y con
una EO adelantada generalmente por encima de 2 DE
sobre la edad cronológica (EC). Es más habitual en las
niñas. La causa más frecuente es la idiopática, sobre
todo en éstas. Alrededor del 30% son formas familia-
res, y recientemente se han descrito determinadas mu-
taciones en el sistema de las kisspeptinas asociadas a
PPC
(6)
. En los niños, por el contrario, son más frecuen-
tes las causas orgánicas. Otro factor importante rela-
cionado con la organicidad es la edad, de forma que, a
menor edad de inicio puberal, mayor riesgo de organi-
cidad. Dentro de este grupo, el hallazgo más frecuente
es el hamartoma hipotalámico
(8,10,12)
.
En la PPP, al contrario que en la PPC, no se pro-
duce activación del eje HHG, sino que éste suele estar
frenado por los esteroides sexuales que pueden prove-
nir de una fuente exógena o endógena. Clínicamente
se caracteriza porque los caracteres sexuales secun-
darios, no sólo pueden perder su secuencia de apari-
ción, sino que, en algunos casos, pueden ser contra-
rios al sexo del paciente, dependiendo del esteroide se-
xual que se encuentre elevado. Entre las causas que lo
pueden presentar están: tumores secretores de hCG,
tumores testiculares, ováricos, suprarrenales, HSC, o
más raras como el S. de McCune-Albright, testotoxi-
cosis
(10,11,12,14)
.
Para la evaluación diagnóstica de la pubertad pre-
coz van a ser fundamentales los datos obtenidos tanto
de la historia clínica como de la exploración física, que
se recomienda realizar siempre en presencia de los pa-
dres y, si es posible también, con personal de enferme-
ría, por las posibles repercusiones legales que pudieran
derivarse de un tema tan delicado. A continuación, y
dependiendo de los datos recogidos previamente, se
solicitarán las pruebas complementarias oportunas.
Dentro de las determinaciones hormonales, la me-
dición de los niveles de estradiol o testosterona tienen
poca utilidad en la práctica clínica, ya que precisan téc-
nicas ultrasensibles para su correcta determinación, de

25
Volumen XIX Nº 2 Noviembre 2012
A
CTUALIZACIÓN
EN
EL
MANEJO
DE
LA
PUBERTAD
las que no se disponen en la mayoría de los laborato-
rios. Por ello, la prueba hormonal más importante en el
diagnóstico de la PP es la determinación de los niveles
séricos de gonadotropinas tras estímulo con análogos
de GnRH, siendo diagnóstico de PP un pico de LH >
7 UI/L
(10)
.
En aquellos casos en los que sospechemos au-
mento de andrógenos suprarrenales (tumor/HSC) es
muy útil la determinación de 17-OH-progesterona y
DHEAS o el test de ACTH si éstos están elevados
(10)
.
La prueba de imagen indicada en primer lugar ante
la sospecha de PP es la EO, ya que el desarrollo pube-
ral suele estar más en relación con la EO que con la EC.
En caso de PP la EO estará adelantada al menos 1 año
con respecto a la EC.
La siguiente prueba que puede aportar información,
sobre todo en niñas, es la ecografía, con la desventaja
de ser una técnica explorador-dependiente. En ella po-
demos valorar el tamaño y forma del útero y ovarios, así
como el desarrollo folicular y endometrial, considerán-
dose puberal, como se dijo previamente, un volumen
ovárico > 1 ml y la presencia de > 6 folículos de > 10
mm de tamaño.
En cuanto a las pruebas de neuroimagen, la RMN es
Tabla I.: Etiopatogenia de la pubertad precoz (PP)
PP Central
PP Periférica
Idiopática
- Esporádica
- Familiar
- Tras adopción internacional
Genética
- Mutaciones activadoras en KISS1
- Mutaciones activadoras en KISS1R (GPR54)
Secundaria a alteraciones del SNC
- Tumores
– Hamartoma hipotalámico
– Craneofaringioma
– Otros: astrocitoma, glioma, ependimoma,
pinealoma, neuroblastoma, etc
- Anomalías congénitas
– Hidrocefalia
– Mielomeningocele
– Defectos del desarrollo del cerebro medio
- Lesiones quísticas
– Quiste aracnoideo, glial o pineal
– Quiste hidatídico
- Infecciones
– Meningitis, encefalitis y abscesos
- Irradiación craneal
- Lesiones vasculares
- Lesiones del SNC de otro tipo
Asociada a determinados cuadros sindrómicos
- Neurofibromatosis tipo I
- S. De Russel-Silver
- S. De Beuren-Williams
- S. De Cohen
- Disomía uniparental materna del cromosona 14
Tras exposición prolongada a esteroides
sexuales (PP mixta)
Función gonadal autómata
- S. De McCune-Albright
- PP familiar del varón o testotoxicosis
- Quistes ováricos.
Tumores gonadales
- Ovario
– Células de la granulosa
– Células de la teca
– Celularidad mixta
- Testículo
– Células de Leydig
– Células de Sertoli (asociación a S.
de Peutz-Jeghers)
– Células de la granulosa
– Otros: restos adrenales, etc
Exposición o ingesta de esteroides sexuales
exógenos
Tumores secretores de HCG (sólo en varones)
- Hepatoblastoma
- Pinealoma
- Germinoma
- Coriocarcinoma
- Teratoma
Patología suprarrenal
- Hiperplasia suprarrenal congénita
- Corticosuprarrenaloma (adenoma o carcinoma)
Hipotiroidismo primario severo
(S. de Van-Wyk-Grumbach)
Resistencia generalizada a los glucocorticoides

26
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
la más indicada. Su solicitud nunca ha sido discutida
en niños por su alta asociación a procesos orgánicos
de base, pero en las niñas se debate aún su indicación.
Las recomendaciones actuales son: todos los niños,
todas las niñas < 6 años, y las niñas entre 6-8 años con
hallazgos neurológicos en la exploración y avance pu-
beral rápido
(14,15)
(Tabla II).
Tabla II.: Indicaciones de RMN
en pubertad precoz
RMN:
- TODOS los niños.
- TODAS las niñas < 6 años.
- Niñas entre 6-8 años con hallazgos neurológi-
cos y avance puberal rápido.
En relación al tratamiento, el principal objetivo será
conseguir una disminución de la velocidad de cre-
cimiento para conservar el potencial de crecimiento
y prevenir, dentro de lo posible, una talla baja adulta.
Además se intentarán minimizar las consecuencias psi-
cológicas y sociales derivadas del adelanto puberal, y,
aunque no siempre se consigue, la regresión, deten-
ción o enlentecimiento del desarrollo de los caracteres
sexuales secundarios.
En la PPC se usan los análogos de la GnRH (tripto-
relina o acetato de leuprorelina). Antes de iniciar el tra-
tamiento es recomendable documentar la progresión
puberal y la aceleración del crecimiento durante al me-
nos 3 o 6 meses, con excepción de aquellas niñas con
un estadío de Tanner de mama > 3 y EO adelantada,
ya que esto predice una rápida evolución de la puber-
tad. Una vez que se decida iniciar el tratamiento debe
hacerse lo antes posible ya que aquellos niños que lo
inician antes de los 6 años son los que presentan un
mayor beneficio a largo plazo en lo que se refiere a talla
final, ya que para obtener dicho beneficio los últimos
estudios aconsejan mantener el tratamiento al menos
durante 2 años; el iniciar tratamiento en edades próxi-
mas a los límites normales tanto de EC como de EO no
se ha relacionado con una mejoría de talla, y, por tanto,
no estaría indicado como práctica habitual. La moni-
torización de la eficacia terapéutica se llevará a cabo
mediante la valoración clínica y auxológica cada 3-6
meses, donde se debe obtener una disminución de la
velocidad de crecimiento así como un enlentecimiento
de la progresión de la EO. Un aspecto controvertido es
cuál sería el momento más adecuado para suspender
el tratamiento. Aunque no existe un consenso genera-
lizado, se recomienda que se suspenda en las niñas a
una EC de 11 años y EO de 12-12.5 y en los niños a
una EC de 12 años y EO de 13-13.5; por encima de
estas edades no aporta mejoría e incluso podría em-
peorar las expectativas de talla adulta
(14)
.
En la PPP se suelen usar tratamientos sintomáticos
en la mayoría de los casos, con fármacos que inhiben
directamente la producción de esteroides sexuales o
su acción sobre los órganos diana (ketoconazol, ace-
tato de ciproterona, espironolactona…), que en gene-
ral no son demasiado eficaces. En caso de sospecha
de hiperplasia suprarrenal congénita, estaría indicada la
hidrocortisona
(10)
.
En el otro extremo está la pubertad retrasada, que
es poco frecuente en la consulta de pediatría por la
edad a la que se diagnostica. Se define por la falta de
aparición de desarrollo puberal en las niñas > 13 años
y en los niños > 14 años. Al contrario que la pubertad
precoz, esta entidad es más frecuente en varones. Las
causas son múltiples y a modo de resumen se pueden
clasificar en 4 grupos:
1) retraso puberal simple, es la causa más frecuente.
Puede considerarse como una variante de la normali-
dad. Aparece generalmente en un contexto familiar de
maduración tardía; 2) secundaria a enfermedades cró-
nicas; 3) hipogonadismos: hipogonadotropo (fallo a
nivel central) o hipergonadotropo (fallo gonadal prima-
rio), en este último grupo hay que tener presente siem-
pre el S. de Klinefelter en los niños y el S. de Turner en
las niñas
(10)
.
Bibliografía
1. Muñoz MT, Pozo J. Pubertad normal y sus
variantes. Pediatr Integral 2011; XV (6): 507-18.
2. Rodriguez F. Pubertad normal femenina. En: Dié-
guez C, Yturriaga R. Actualizaciones en endocrinología.
Pubertad. Madrid: McGraw-Hill, 2006; 1-10.
3. Chowen J, Frago L. Sistema nervioso central y
pubertad. En: Diéguez C, Yturriaga R. Actualizaciones
en endocrinología. Pubertad. Madrid: McGraw-Hill,
2006; 19-32.
4. Tena-Sempere M. Kisspeptinas y pubertad. An
Pediatr 2007; 66 (supl 1): 31-7.
5. Ojeda SR, Lomniczi A, Sandau U. Contribution of
glial-neuronal interactions to the neuroendocrine control
of female puberty. Eur J Neurosci 2010; 32: 2003-10.
6. Rogol AD. Sex steroids, growth hormone, leptin
and the pubertal growth spurt. Endocr Dev 2010; 17:
77-85.
7. Martul P, Rica I, Vela A. Pubertad normal mas-
culina. En: Diéguez C, Yturriaga R. Actualizaciones en
endocrinología. Pubertad. Madrid: McGraw-Hill, 2006;
11-17.
8. Speiser PW, Azziz R, Baskin LS, Ghizzoni L,
Hensle TW, Merke DP, et al.; Endocrine Society. Conge-
nital adrenal hyperplasia due to steroid 21-hydroxylase
deficiency: an Endocrine Society Clinical Practice Gui-
deline. J Clin Endocrinol Metab 2010; 95: 4133-60.
9. López-Canti, Luis. Pubertad precoz periférica.
En: Diéguez C, Yturriaga R. Actualizaciones en endocri-
nología. Pubertad. Madrid: McGraw-Hill, 2006; 73-84.

27
Volumen XIX Nº 2 Noviembre 2012
A
CTUALIZACIÓN
EN
EL
MANEJO
DE
LA
PUBERTAD
10. Yturriaga R, Gaztelu L, Lara E. Pubertad precoz
central. En: Diéguez C, Yturriaga R. Actualizaciones en
endocrinología. Pubertad. Madrid: McGraw-Hill, 2006;
53-71.
11. Pozo J, Muñoz MT. Pubertad precoz y retraso
puberal. Pediatr Integral 2011; XV (6): 523-43.
12. Parent AS, Teilmann G, Juul A, Skakkebaek NE,
Toppari J, Bourguignon JP. The timing of normal puberty
and the age limits of sexual precocity: variations around
the world, secular trends, and changes alter migration.
Endocrine Reviews 2003; 24 (5): 668-693.
13. Teilmann G, Pedersen C, Kold T, Skakkebaek
E, Juul A. Prevalence and Incidence of Precocious
Pubertal Development in Denmark: An Eppidemiologic
Study Based on National Registries. Paediatrics 2005:
116; 1323-28.
14. Carel JC, Léger J. Precocious Puberty. N Engl J
Med 2008; 358: 2366-77.
15. Carel JC, Eugster E, Rogol A, Ghizzoni L, Palmett
M. GnRH Analogs Consensus Conference Group. Pae-
diatrics 2009: 123: 752-62.
| Adjunto | Tamaño |
|---|---|
| voxpaed19.2pags22-27.pdf | 190.38 KB |



