![]()
Formulación magistral en pediatría

30
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
Formulación magistral en pediatría
Martínez-Boné Montero E.*, Coronado Núñez M.J.**,
Martínez-Boné Cabello de los Cobos F.***, Rite Zambrano I.**,
Mier Palacios M.* y Díaz Suárez M.*.
* Hospital Infanta Elena del SAS, Huelva.
** Ilustre Colegio Oficial de Farmacéuticos de Huelva, Huelva.
*** Centro de Salud Montequinto, Dos Hermanas, Sevilla
Dir. Corresp.: Martínez-Boné Montero E. C/ Palos, 3, 4º B, 21003 Huelva
emarbomon@yahoo.es
Recibido: 10-02-12 Aceptado:12-03-12
Vox Paediatrica 2012; XIX(1):30-42
Introducción
L
a Formulación Magistral ha sido durante siglos, y
hasta hace pocas décadas, la única vía de ela-
boración de forma apropiada de los medicamen-
tos para uso medicinal. El desarrollo de la industria far-
macéutica ha ampliado notablemente las posibilidades
de investigación y producción a gran escala de medi-
camentos; sin embargo, este desarrollo ha provocado
un cierto grado de “despersonalización” del mismo,
siendo el paciente el que se adapta al medicamento de
origen industrial (dosis y formas farmacéuticas prede-
terminadas), en lugar de adaptarse éste a las caracte-
rísticas específicas de cada paciente
(1)
.
Este aspecto es especialmente importante en la po-
blación pediátrica, prácticamente huérfana
(2)
en cuanto
a la disponibilidad de medicamentos específicamente
diseñados para ella
(3)
. Según la Organización Mundial
de la Salud (OMS), más de la mitad de los niños en paí-
ses desarrollados reciben medicamentos cuyas dosis
están preparadas para adultos y no cuentan con au-
torización para ser usados en menores
(4)
. Así, se sabe
que un 70% de los medicamentos comercializados no
incluyen datos pediátricos suficientes
(5)
, especialmente
en lo que respecta a la dosificación, porcentaje que
puede alcanzar el 90% en neonatos
(6,7)
. Todo ello con-
lleva a un aumento de errores y problemas asociados
a la medicación, notoriamente más frecuentes en la in-
fancia que entre adultos
(8,9)
.
En una consulta realizada en diversos hospitales que
elaboran fórmulas magistrales (FMs) líquidas, se puso
de manifiesto que de los 92 principios activos (PAs)
precisos para elaborar FMs, un tercio de ellos no tie-
nen aprobada indicación alguna en pediatría y otros
muchos presentan limitaciones en lo que respecta a la
edad (>12 años, >6 años, >2 años…) u observaciones
del tipo “datos limitados”, “precaución en condicio-
nes especiales”, etc.…
(4)
.
Un estudio paralelo llevado a cabo en servicios
neonatales de seis hospitales españoles demostró que
el 17,6% de los pacientes estaban en tratamiento con
medicamentos no autorizados, debido a la edad (78%
de los casos), o a su empleo en indicaciones no autori-
zadas (21,3%). En el 22% de los pacientes se hizo ne-
cesaria la elaboración de FMs por no existir presenta-
ciones comerciales adecuadas a la edad pediátrica
(10)
.
Este problema se extiende también a nivel europeo;
así, un estudio realizado en cinco hospitales europeos
ha puesto de manifiesto que el 67% de los niños in-
gresados recibieron fármacos prescritos fuera de los
términos de autorización (“off-label”) en relación a la
edad, indicación, dosis o frecuencia, vía de adminis-
tración o formulación
(11)
. Según la edad y la enferme-
dad de base de los pacientes se ha observado que el
uso “off-label” puede variar desde un 30% hasta un
90%
(12)
.
Por otra parte, los excipientes son necesarios para
la elaboración de una FM y, aunque pueden ser segu-
ros en adultos, pueden ser críticos en niños, especial-

31
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
mente recién nacidos, debido a una insuficiente capa-
cidad metabólica en el primer mes de vida, diferencias
en el aclaramiento renal, menor tasa en el filtrado glo-
merular y una barrera hematoencefálica más permea-
ble
(13)
. Cabe, además, señalar que no existen guías de
excipientes aceptables en niños.
Esta ausencia de preparaciones específicas pediátri-
cas y el empleo de medicamentos sin indicación para
niños o contraindicados han llevado a las autoridades
europeas y nacionales a tomar medidas precisas y
asignar suficientes recursos para estimular el desarrollo
de medicamentos para niños mediante la realización
de ensayos clínicos (EC) pediátricos
(14)
. No obstante,
no hay que olvidar que este tipo de ensayos son difí-
ciles de llevar a cabo por motivos muy diversos: me-
todológicos, dificultad en el reclutamiento de pacien-
tes, necesidad de definir diferentes grupos de edades
(prematuros, neonatos, lactantes, párvulos, escolares y
adolescentes, mujer embarazada, feto), etc.…
A pesar de estas dificultades, EEUU (1997), a través
de la Best Pharmaceuticals for Children Act (BPCA)
(15)
y posteriormente Europa (2007), a través de la Agen-
cia Europea del Medicamento (EMA)
(16)
y la OMS
(17)
han
dictado medidas para facilitar la realización de EC pe-
diátricos, proporcionando recursos económicos y prio-
rizando los medicamentos que precisan más informa-
ción a este respecto. Así, anualmente se publican las
denominadas Listas de Medicamentos Esenciales que
incluyen los medicamentos para los que se requiere
más información y que se consideran prioritarios para
asegurar la salud infantil
(17)
. Paralelamente, se ha es-
tablecido la obligación de incluir niños en los EC de
los nuevos medicamentos en estudio. En 2007, en Eu-
ropa, es creado el Comité Pediátrico: European Pae-
diatric Formulation Initiative (EuPFI) para valorar los
Planes de Investigación Pediátricos (PIP), siendo im-
prescindible la presentación de los mismos para iniciar
la tramitación y registro de un nuevo medicamento
(18)
.
Este comité pediátrico europeo se ha centrado en las
siguientes líneas de trabajo: sistemas adecuados
de administración de medicamentos, adecuación a la
edad de la formulación, tests para enmascaramiento
de sabores, excipientes y preparaciones extemporá-
neas. Se trata de una red y foro de discusión, integrada
por formulistas pediátricos expertos procedentes de
la industria, universidad y farmacia clínica, que tienen
como observador a la EMA
(13)
. De 2007 a 2010 se han
recibido 700 PIP, de los que se han revisado 200 hasta
2010
(18)
.
En Europa, además, se cuenta con una Red Euro-
pea de Investigación Pediátrica y un registro especí-
fico de EC en niños financiados por la Comisión Euro-
pea
(19)
. Paralelamente, se ha seleccionado en convo-
catoria pública el proyecto GRIP (Global Research in
Pediatrics), red de excelencia para la promoción de
medicinas para niños, que tiene como objetivos princi-
pales desarrollar un programa de farmacología pediá-
trica y valorar las limitaciones en el desarrollo de medi-
camentos infantiles, y que incluye un grupo de trabajo
de neonatología.
Pero España no se ha quedado atrás y, reciente-
mente, se ha formado un Grupo de Trabajo sobre
Medicamentos Pediátricos, dependiente de la Agen-
cia Española de Medicamentos y Productos Sanita-
rios (AEMPS) y se ha creado la primera plataforma de
EC (CAIBER), diferenciándose en ella la plataforma de
EC pediátricos
(14)
. En los últimos años se han llevado a
cabo diversos EC pediátricos en la comunidad autó-
noma andaluza: 14 en el 2004, 7 en 2005, 8 en 2006,
12 en 2007 y 11 en 2008 (6 de ellos en el Hospital Vir-
gen Macarena de Sevilla)
(4, 20)
.
La Asociación Española de Pediatría (AEP) se ha
reunido con el Comité de Medicamentos para niños
con objeto de desarrollar un “Pediamecum”, vademe-
cum pediátrico organizado por PAs con fichas técnicas
individualizadas
(14)
.
Parece ser, por tanto, que la creación de una verda-
dera Plataforma Internacional de Farmacología Pediá-
trica que forme profesionales en la materia y facilite los
EC farmacológicos en niños es un objetivo común
(21)
.
Mientras se avanza en este sentido, no cabe duda
que la formulación magistral juega un papel fundamen-
tal en el ámbito pediátrico, al permitir, en parte, resolver
muchas de las lagunas terapéuticas existentes en la
actualidad. Así, la formulación magistral posibilita ela-
borar dosificaciones o formas farmacéuticas distintas
a las comercializadas con objeto de adecuarse al pro-
ceso evolutivo de la enfermedad o a las necesidades
y/o características particulares del niño, permitiendo,
además, eliminar o sustituir excipientes en caso de
alergias o interacciones.
Igualmente, facilita la administración del fármaco con
el fin de mejorar el cumplimiento terapéutico al permitir
modificar las características organolépticas del medi-
camento, administrar preparados con escaso tiempo
de estabilidad, asociar varios PAs en una única forma
farmacéutica, etc.…Finalmente, hay que destacar tam-
bién que permite solucionar las situaciones de desa-
bastecimiento o retirada de medicamentos fabricados
industrialmente susceptibles de ser utilizados por esta
población y que, en ocasiones, se producen.
El valor de la formulación magistral es cada vez más
reconocido por expertos internacionales por ser la op-
ción terapéutica que mejor se adapta al perfil fisiopa-
tológico específico de cada paciente. Las nuevas ten-
dencias terapéuticas como la farmacogenómica o la
nanofarmacia muestran con claridad la dirección en la
que avanza la terapéutica: la individualización.
Marco legal
La actual normativa técnico-legal que regula la cali-
dad de la formulación magistral es igual de exigente y
rigurosa que la correspondiente a los medicamentos

32
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
fabricados industrialmente e incluye desde los princi-
pios activos y el resto de materias primas hasta la ela-
boración y etiquetado.
A nivel europeo, existen actualmente estableci-
das las siguientes directrices:
– Reglamento (CE) Nº 1901/2006 del Parlamento
Europeo y del Consejo. Sobre medicamentos para
uso pediátrico y por el que se modifican el Regla-
mento (CEE) nº 1768 / 92, la Directiva 2001/20/
CE, la Directiva 2001/83/CE y el Reglamento (CE)
nº 726 / 2004. Diario Oficial de la Unión Europea,
2006, con efecto para el 26 de enero de 2007.
– Respecto a los Planes de Investigación Pediá-
trica: Reglamento (CE) Nº 1901/2006, capítulo 3,
sección I, artículo 15.2.
– Referencias regulatorias del PIP: 2008/
C243/2001, EMEA/CHMP/PEG/194/810/2005,
EMEA/138931/2008.
– Regulación de excipientes: CHMP/
QWP/396951/06, revisado en 2008.
– Directiva sobre legislación de alimentos:
» Directiva 2006 / 52 / EC: Aditivos alimentarios.
» Directiva 94 / 35 / EC: Edulcorantes.
» Directiva 94 / 36 / EC: Colorantes.
» Directiva 2009 / 35 / EC: Colorantes para me-
dicinas.
– OMS, 26/04/2007: Nueva lista de Medicamentos
Esenciales. Prioriza los fármacos pediátricos. Con-
tiene 206 medicinas consideradas prioritarias para
asegurar la salud infantil.
A nivel nacional, la formulación magistral está re-
gulada por:
– Real Decreto 175/2001, de 23 de febrero, por el
que se aprueban las normas de correcta elabora-
ción y control de calidad de fórmulas magistrales
y preparados oficinales (BOE nº 65, 16/03/01). El
plazo de adecuación a esta norma fue ampliado
al 1 de enero de 2004 mediante el Real Decreto
905/2003 (BOE nº 166, 12/07/03).
– Ley 29/2006, de 26 de julio, de garantías y uso
racional de medicamentos y productos sanitarios
(BOE nº 178, 27/07/06) artículos 42, 43 y 44.
– Real Decreto 824/2010, de 25 de junio, por el que
se regulan los laboratorios farmacéuticos, los fabri-
cantes de principios activos de uso farmacéutico
y el comercio exterior de medicamentos y medica-
mentos en investigación (BOE nº 165, 08/07/10).
– Orden SCO/3262/2003, de 18 de noviembre, por
la que se aprueba el formulario nacional (BOE nº
283, 26/11/03) así como su actualización (Orden
SCO/3123/2006, de 29 de septiembre, BOE nº
244, 12/12/06).
– Orden SPI/2891/2010, de 3 de noviembre, por la
que se aprueba la 4ª edición de la Real Farmaco-
pea Española (BOE nº 273, 11/11/10).
– Orden de 14 de febrero de 1997 por la que se
establecen determinados requisitos en la pres-
cripción y dispensación de fórmulas magistrales
y preparados oficinales para tratamientos pecu-
liares (anorexígenas, psicotrópicas, hormonales,
laxantes y diuréticas solas o asociadas) (BOE nº
49, 26/02/97).
– Orden de 13 de mayo de 1985 sobre medicamen-
tos sometidos a especial control médico en su
prescripción y utilización (BOE nº 121, 21/05/85).
– Real Decreto 1718 / 2010 de 17 de diciembre de
2010, normativa sobre recetas médicas y órdenes
de dispensación.
A nivel autonómico:
Andalucía:
– Ley 22/2007, de 18 de diciembre, de Farmacia de
Andalucía (BOJA nº 254, 28/12/07). Artículo 13.
– Convenio por el que se fijan las condiciones para
la ejecución de la prestación farmacéutica a través
de las oficinas de farmacia (11/07/11).
– Proyecto de Decreto en Andalucía para la aplica-
ción de las normas de correcta elaboración y con-
trol de calidad de fórmulas magistrales y prepara-
dos oficinales en Andalucía (29/07/05).
Extremadura:
– Ley 6/2006, de 9 de noviembre, de Farmacia de
Extremadura (BOE nº 134, 16/11/06). Artículos 11,
45 y 50.
– Guía de Aplicación de Normas Correctas de Ela-
boración y Control de Calidad de Fórmulas Magis-
trales y Preparados Oficinales a Oficinas de Far-
macia y Servicios Farmacéuticos. Consejería de
Sanidad y Dependencia. Junta de Extremadura.
Actualización 2010.
– Concierto entre la Consejería de Sanidad y Depen-
dencia, el Servicio Extremeño de Salud y el Con-
sejo de Colegios Profesionales de Farmacéuticos
de Extremadura por el que se fijan las condiciones
para la ejecución de la prestación farmacéutica a
través de las Oficinas de Farmacia y acuerdos de
otras prestaciones (18/05/11).
Definiciones
? Fórmula Magistral (FM): Medicamento desti-
nado a un paciente individualizado, preparado por un
farmacéutico o bajo su dirección, para cumplimentar
expresamente una prescripción facultativa detallada de
los principios activos que incluye, según las normas de
correcta elaboración y control de calidad establecida
al efecto, dispensado en oficina de farmacia o servi-

33
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
cio farmacéutico y con la debida información al usuario
en los términos previstos en el artículo 42.5 de la Ley
29/2006.
? Fórmula Magistral Tipificada (FMT): Fórmula
Magistral recogida en el Formulario Nacional por razón
de su frecuente uso y utilidad.
? Preparado Oficinal (PO): Medicamento elabo-
rado según las normas de correcta elaboración y con-
trol de calidad establecidas al efecto y garantizado por
un farmacéutico o bajo su dirección, dispensado en ofi-
cina de farmacia o servicio farmacéutico, enumerado y
descrito en el Formulario Nacional, destinado a su en-
trega directa a los enfermos a los que abastece dicha
farmacia o servicio farmacéutico.
? Principio Activo (PA): Toda materia, cualquiera
que sea su origen- humano, animal, vegetal, químico
o de otro tipo- a la que se atribuye una actividad apro-
piada para constituir un medicamento.
? Excipiente: Aquella materia que, incluida en las
formas galénicas, se añade a los principios activos o
a sus asociaciones para servirles de vehículo, posibili-
tar su preparación y estabilidad, modificar sus propie-
dades organolépticas o determinar las propiedades fí-
sico-químicas del medicamento y su biodisponibilidad.
? Materia prima: Toda sustancia- activa o inac-
tiva- empleada en la fabricación de un medicamento,
ya permanezca inalterada, se modifique o desaparezca
en el transcurso del proceso.
? Forma galénica o forma farmacéutica: la dis-
posición a la que se adaptan los principios activos y
excipientes para constituir un medicamento. Se define
por la combinación de la forma en la que el producto
farmacéutico es presentado por el fabricante y la forma
en la que es administrada.
? Procedimiento: Conjunto de operaciones que
deben realizarse, precauciones que han de tomarse y
medidas que deberán aplicarse, relacionadas directa o
indirectamente con la elaboración de un medicamento.
? Procedimiento Normalizado de Trabajo (PNT):
Procedimientos escritos y aprobados según las normas
de correcta elaboración y control de calidad que descri-
ben, de forma específica, las actividades que se llevan a
cabo tanto en la elaboración de una fórmula magistral o
preparado oficinal como en su control de calidad.
? Real Farmacopea Española: Código que esta-
blece la calidad que deben cumplir los principios acti-
vos y excipientes que componen los medicamentos de
uso humano y veterinario. Incluye monografías conve-
nientemente ordenadas y codificadas con las especifi-
caciones de identidad, pureza y riqueza de, como mí-
nimo, los principios activos y excipientes, así como los
métodos analíticos oficiales y textos generales necesa-
rios para la correcta aplicación de las monografías. Las
especificaciones definidas en las monografías consti-
tuyen exigencias mínimas de obligado cumplimiento.
La Real Farmacopea Española está constituida por las
monografías contenidas en la Farmacopea Europea del
Consejo de Europa y, en casos justificados, por las mo-
nografías peculiares españolas. Se actualizará y publi-
cará periódicamente. Las Oficinas de Farmacia y servi-
cios farmacéuticos deben garantizar que disponen de
acceso a la actualización vigente.
? Formulario Nacional: Registro oficial que contiene
las fórmulas magistrales tipificadas y los preparados ofi-
cinales reconocidos como medicamentos, sus catego-
rías, indicaciones y materia prima que intervienen en su
composición o preparación, así como las normas de co-
rrecta preparación y control de aquéllos. Las Oficinas
de Farmacia y servicios farmacéuticos deben garantizar
que disponen de acceso a la actualización vigente.
Prescripción de Fórmulas Magistrales y
preparados oficinales
La prescripción de una FM o PO es llevada a cabo
por pediatras de atención primaria o especializada
para tratar patologías agudas o crónicas. Estos pedia-
tras pueden ejercer su actividad tanto en el ámbito pú-
blico como privado, si bien, la financiación de las dis-
tintas FMs o POs estará determinada por las condi-
ciones establecidas en los conciertos autonómicos co-
rrespondientes.
Según establece la nueva normativa sobre receta
médica y órdenes de dispensación (RD 1718/2010, de
17 de diciembre), la prescripción de una FM o PO se
deberá llevar a cabo siguiendo los siguientes criterios:
? Datos del paciente: nombre, apellidos, año de
nacimiento y
» En recetas u órdenes de dispensación públicas:
código de identificación
» En recetas u órdenes de dispensación privadas:
DNI o NIE (extranjero)
? Datos de la FM o PO:
» Principio/s activo/s (PAs) y dosificación
3 Fórmula Magistral: En recetas médicas
u órdenes de dispensación públicas está
establecido autonómicamente detallar la
composición cualitativa y cuantitativa com-
pleta, al menos, de los PAs y excipientes
de declaración obligatoria.
3 Preparado Oficinal o Fórmula Magistral
Tipificada: denominación según establece
el Formulario Nacional.
» Forma farmacéutica: En el ámbito pediátrico se
prescriben principalmente formas farmacéuticas
orales líquidas (soluciones, suspensiones…)
y formas tópicas (emulsiones, geles…); en
ocasiones pueden prescribirse enemas para
administración rectal, aunque suele ser menos
usual. Recientemente, se han comenzado a
emplear en pediatría formas farmacéuticas más

34
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
novedosas tales como chupa-chups con tetra-
caína para uso oncológico, gominolas multi-
vitamínicas, polos helados de nistatina o finas
láminas de polietilenglicol, por citar algunos
ejemplos
(22)
. A este respecto, es importante
destacar el gran déficit en FMs para niños que
se observa en el Formulario Nacional vigente
actualmente, al recoger únicamente siete
Fórmulas Magistrales Tipificadas (FMTs) líquidas
y para las indicaciones señaladas:
3 Hidrato de cloral jarabe (10%): sedante/
hipnótico en pruebas diagnósticas
3 Hidrato de cloral enema (5%): ansiolítico/
hipnótico en pruebas diagnósticas
3 Morfina 1% solución (4 mg/ml jarabe):
analgésico opiáceo en dolor intenso
3 Metadona 1% solución (no empleado en
pediatría)
3 Ipecacuana 7% jarabe: inducir vómito en
intoxicaciones orales
3 Lidocaína compuesta suspensión bucal
(1%): dolor orofaríngeo, aftas bucales
3 Lidocaína viscosa gel bucal (1%): dolor
orofaríngeo, aftas bucales.
Por ello sería conveniente que el Formulario Na-
cional incluyera las fórmulas líquidas orales más
frecuentemente preparadas por los Servicios
Hospitalarios como FMTs.
» Vía de administración: oral, tópica, rectal…
» Posología.
» Duración total del tratamiento.
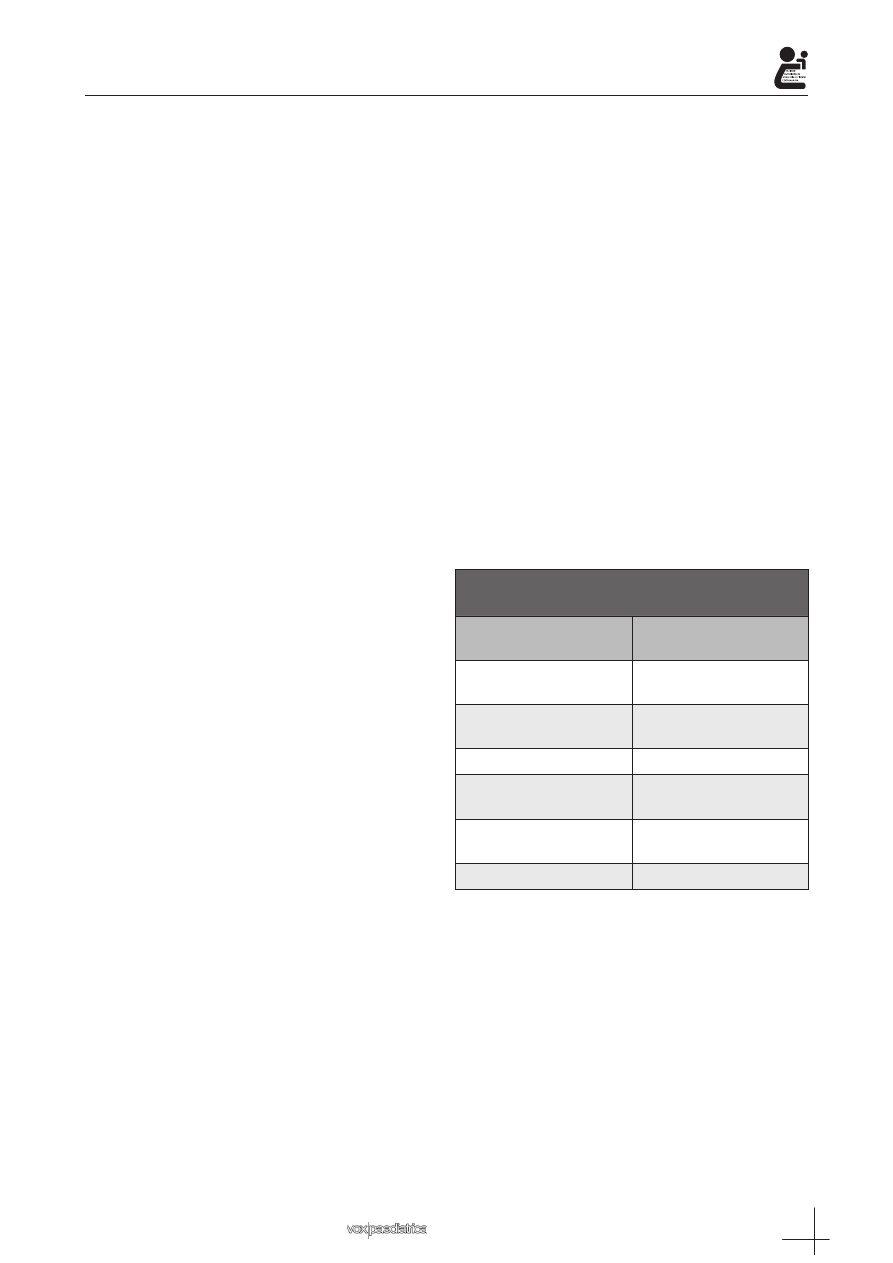
Tabla I. Principales abreviaturas tradicionalmente empleadas en Formulación Magistral
Abreviatura Significado
Prescripción
D o Dp
Dispénsese
R o Rp (recipe)
Tómese
Composición
aq. (aquaaq)
Agua
aq.dest. (aqua destillata)
agua destilada
co. (compositum)
compuesto
dil. (dilue)
diluido
q.s. (quantum satis)
en cantidad suficiente
c.s.p.
cantidad suficiente para
a-a (ana-ana)
a partes iguales
s.s. (semis)
una mitad
Qu.I. (quantum libet)
tanto como sea necesario
Forma farmacéutica
cp
cápsulas
c
comprimidos
W/O o A/O
emulsión fase externa oleosa
O/W o O/A
emulsión fase externa acuosa
W/S
Emulsión silicónica
Elaboración
h.s.a.
hágase según arte
m.s.a
mézclese según arte
d.s.a.
disuélvase según arte
m.o.
modus operandi
Posología y recomendaciones al
paciente
h.s. (hora somni)
al acostarse
a.c. (antes cibos)
antes de las comidas
p.c. (post cibos)
después de las comidas
o.m. (omni mane)
cada mañana
q.4h (quarte quaque hora)
cuatro veces al día
t.i.d. (ter in die)
tres veces al día
c.c. (cum cibis)
con alimento
Ad.Lib. (ad libitum)
tanto como desee
35
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
En receta médicas u órdenes de dispensación ma-
nuales suele indicarse la abreviatura de una palabra im-
perativa dirigida al farmacéutico como D o Dp (dispén-
sese) o R ó Rp, del latín: récipe (tómese). Asimismo, se
han empleado tradicionalmente otras abreviaturas que
se resumen en la anterior tabla (Tabla I).
? Datos del prescriptor.
» Nombre y dos apellidos.
» Población y dirección donde ejerza.
» Número de colegiado o código de identificación
asignado por la administración.
» Especialidad oficialmente acreditada que ejerza.
» Firma personal o electrónica.
? Fecha de prescripción (día, mes, año).
? Información al farmacéutico: en formulación ma-
gistral se considera básico tener un estrecho con-
tacto con el farmacéutico, bien sea personal, tele-
fónico o escrito, con objeto de matizar cualquier
duda que se pueda plantear ante una prescripción
(dosificaciones de PAs, inestabilidad o incompati-
bilidades de la FM, intolerancias a excipientes, in-
teracciones con otros tratamientos, etc.…).
La normativa vigente establece que las FMs y POs
no podrán prescribirse conjuntamente en una misma
receta médica u orden de dispensación con otros me-
dicamentos y que sólo se podrá prescribir una FM o
PO por cada receta u orden de dispensación.
Elaboración de Fórmulas Magistrales y
preparados oficinales
La elaboración de FMs o POs sólo puede llevarse
a cabo en Oficinas de Farmacia (OFs) y Servicios Far-
macéuticos legalmente establecidos. Excepcional-
mente, es posible encomendar a una entidad, debida-
mente autorizada, la realización de una o varias fases
de la elaboración y/o control de FMs. Este caso está
contemplado expresamente en diferentes normativas
y conciertos autonómicos y para ello la OF o Servicio
Farmacéutico deberá disponer de un documento con-
tractual firmado por ambas partes en el que se esta-
blezcan claramente las obligaciones de cada uno. Aun-
que es un camino que aún hay que perfilar, esta me-
dida facilita la accesibilidad al tratamiento de pacientes
pediátricos una vez recibido el alta hospitalaria, ya que
en algunas ocasiones, los pacientes encuentran dificul-
tades para adquirir las FMs prescritas en el hospital.
Prescripción
Ante la prescripción de una FM es imprescindible
que el farmacéutico valore la idoneidad de la misma.
Así pues, sólo podrán elaborarse FMs o POs con sus-
tancias de acción e indicación reconocidas legalmente
en España. Este punto crea continuamente situaciones
comprometidas debido a la ausencia de indicaciones
autorizadas para la población pediátrica, como ya se
ha comentado. En estos casos, se hace imprescindible
recurrir al tradicionalmente denominado “uso compa-
sivo” (“off-label”), que autoriza la elaboración de una
FM empleando sustancias en indicaciones no autori-
zadas en nuestro país. En la actualidad, este tipo de
gestión está prácticamente restringida al ámbito hospi-
talario, motivo por el que muchas OFs no pueden ela-
borar FMs prescritas en el hospital; este hecho dificulta
enormemente la continuidad de tratamiento al alta hos-
pitalaria antes comentada.
Por otro lado, gran parte de las denominadas en-
fermedades raras se diagnostican en edades pediátri-
cas, bien por origen genético o infeccioso. Los medica-
mentos huérfanos se definen, según la Unión Europea,
como aquellos destinados a establecer un diagnós-
tico, prevención o tratamiento de una enfermedad que
afecte a menos de 5 personas cada 10.000 habitantes
o cuya comercialización resulte poco probable (sin in-
terés comercial) y cuyos beneficios sean significativos
para los afectados. En pediatría, son numerosas las
FMs elaboradas con PAs de medicamentos calificados
como medicamentos huérfanos
(23)
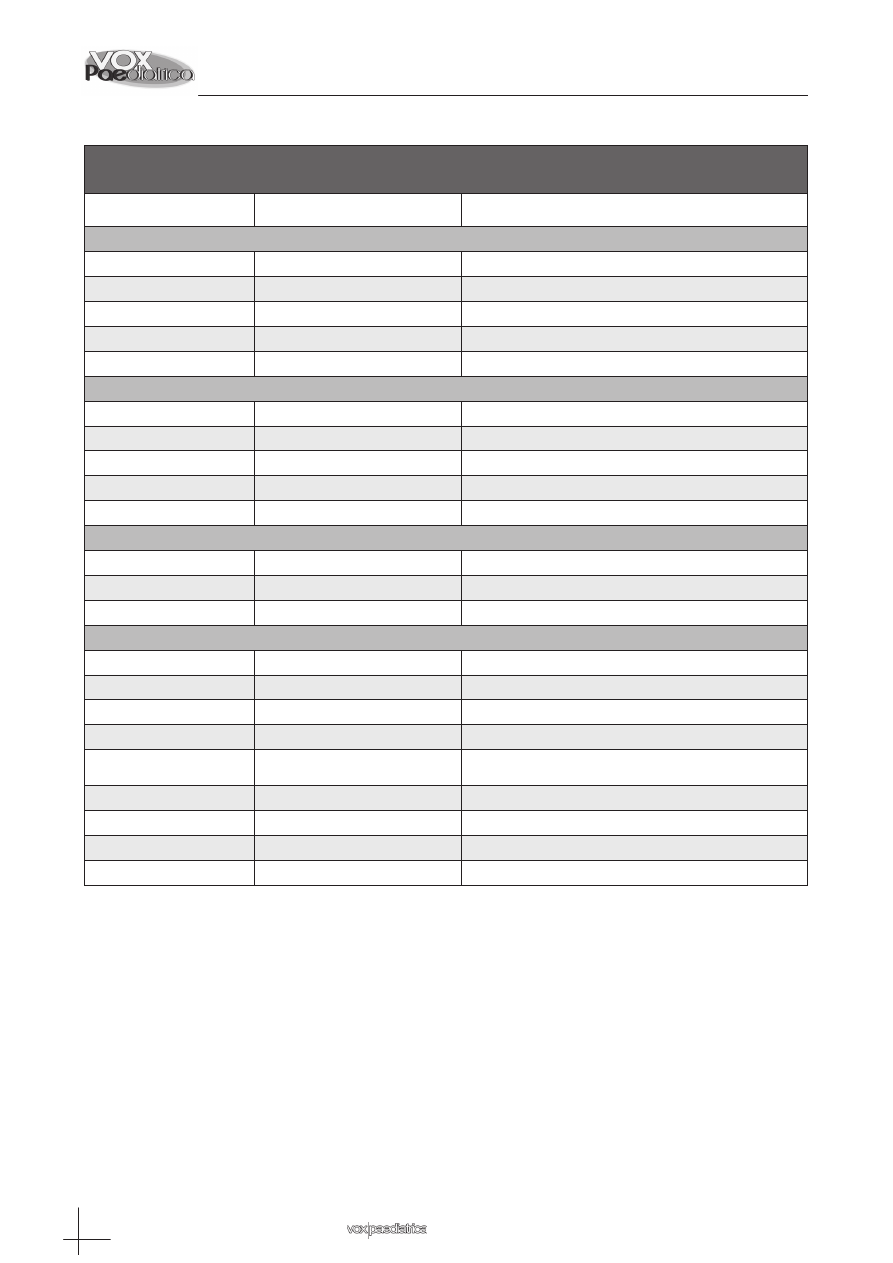
. La Tabla II muestra
algunos ejemplos de PAs indicados en pediatría para
enfermedades raras.
Tabla II: Medicamentos Huérfanos empleados
en pediatría. Ejemplos.
Medicamento
huérfano
Patología
Sildenafilo 2,5 mg/ml
suspensión oral
Hipertensión arterial
pulmonar
3,4 diaminopiridina
Síndrome miasténico
congénito
Difenciprona
Alopecia universalis
Benzoato sódico
solución acuosa
Hiperglicinemia no
cetósica
Hidrocortisona 1 mg/ml
suspensión oral
Hiperplasia adrenal
congénita
Cisteamina
Cistinosis nefropática
En otras ocasiones, es necesario recurrir a los Servi-
cios de Medicación Extranjera con objeto de acceder a
las formas orales líquidas de medicamentos comercia-
lizadas en otros países como: anfotericina B (FUNGI-
ZONE
®
suspensión 100 mg/ml 40 ml), carbamazepina
(TEGRETOL
®
suspensión 100 mg/ml, 450 ml), dexa-
metasona (DEXAMETASONA INTESOL
®
solución 1
mg/ml,30 ml), etosuximida (ZARONTIN
®
250 mg/5 ml
jarabe), fenitoína (EPANUTIN
®
30 mg/5 ml suspensión
500 ml), primidona (MYSOLINE
®
250 mg/ml suspen-
sión 240 ml), ranitidina (AZANTAC
®
15 mg/ml solución
30-200 ml), etc.…
Ante la prescripción de una FM, hay que destacar
que el farmacéutico debe validarla en lo que respecta
a eficacia y seguridad. Así pues, es esencial interpretar
con seguridad la naturaleza de los PAs y excipientes y

36
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
las dosis prescritas de los mismos, comprobando que
éstas están dentro de los límites establecidos; habrá,
además, que comprobar la presencia de incompati-
bilidades o inestabilidades farmacodinámicas y/o far-
macocinéticas, así como interacciones farmacológicas
significativas entre sus componentes o con el resto de
la medicación del niño.
En la actualidad, existen distintas referencias biblio-
gráficas para una misma FM. No en vano un estudio lle-
vado a cabo por Brion y col. en 2003 puso de manifiesto
el hecho de que en 16 países europeos la formulación
magistral se resuelve de forma diferente
(24,25)
. Sin em-
bargo, se han descrito numerosas FMs líquidas de PAs
sin que se hayan documentado problemas de eficacia
o seguridad en las mismas
(26)
. A este respecto, desde
hace varios años, en Andalucía se están celebrando
encuentros entre profesionales sanitarios de distintos
ámbitos (pediatras de atención primaria y atención es-
pecializada, farmacéuticos hospitalarios y farmacéu-
ticos comunitarios) con objeto de unificar los criterios
para la elaboración de FMs destinadas a la población
infantil
(27, 28 y 29)
. A tal efecto, sería conveniente que en el
Formulario Nacional apareciesen como FMTs, al me-
nos, las fórmulas líquidas pediátricas más frecuentes.
Mientras tanto, se hace necesario consensuar criterios
de elaboración de FMs pediátricas valorando la estabi-
lidad, dosificación, posología, indicación, coste, acep-
tación, biodisponibilidad, efectividad, conservación y
forma farmacéutica prescrita. En los últimos años, y
fruto de estos encuentros, se ha comenzado la valida-
ción de FMs pediátricas que contienen los PAs capto-
pril, enalapril, propanolol, ranitidina, espironolactona y
furosemida
(28)
y se ha propuesto llevar a cabo similares
estudios con otros grupos de PAs (fenobarbital, gaba-
pentina, hidrato de cloral, hidroclorotiazida, isoniazida,
omeprazol, tacrolimus y ácido ursodesoxicólico)
(29)
.
Procedimientos Normalizados de Trabajo (PNT)
Los PNT son procedimientos escritos y aprobados
que describen específicamente las actividades que se
llevan a cabo tanto en la elaboración de una FM o PO
como en su control de calidad, como ya se han de-
finido anteriormente. Las Normas de Correcta Elabo-
ración y Control de Calidad permiten al farmacéutico
garantizar la calidad de sus preparaciones. Así pues,
será necesario precisar por escrito las atribuciones del
personal, las normas de higiene y el mantenimiento y
limpieza del local y del utillaje así como toda la docu-
mentación relativa a materias primas, material de acon-
dicionamiento, elaboración, control y registro, etique-
tado e información al paciente. La Figura 1 muestra
un ejemplo de Procedimiento Normalizado de Trabajo
específico para la elaboración de una solución de ena-
laprilo a una concentración de 1 mg/ml
(30)
.
Principios Activos
La elaboración de FMs o POs siempre debe llevarse
a cabo con materias primas procedentes de proveedo-
res debidamente acreditados, que adjunten los corres-
pondientes certificados de análisis. En la actualidad, de
los 97 PAs utilizados habitualmente para elaborar FMs
pediátricas, más del 31% de ellos no están disponi-
bles en el mercado
(31)
. Así, aunque las FMs no deben
prepararse a partir de un medicamento fabricado in-
dustrialmente, algunas normativas autonómicas, entre
ellas la andaluza, contemplan excepciones en aquellos
casos en los que existe desabastecimiento de alguna
de las sustancias medicinales prescritas y se precise
modificar la forma galénica del medicamento comer-
cializado o se requiera un ajuste terapéutico del mismo.
Para ello, es necesario que el farmacéutico comunique
por escrito a la Consejería de Salud esta circunstancia
y sea autorizado su empleo (Ley 22/2007 de Farmacia
de Andalucía, Art. 13.6).
Por otro lado, la validación de un procedimiento para
la elaboración de una FM conlleva el control de las ca-
racterísticas organolépticas con determinaciones analí-
ticas de estabilidad, estudios de farmacocinética y de
respuesta clínica del paciente, etc.… Este control es
necesario para proporcionar un alto grado de seguri-
dad en la obtención de una FM con unas especificacio-
nes y unos atributos de calidad predeterminados. En la
actualidad, sólo se dispone de procedimientos valida-
dos para la elaboración de una FM empleando un PA
en un 26% de los casos
(31)
. Este hecho, unido a que el
Figura 1: Ejemplo de Procedimiento Normalizado
de Trabajo.

37
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
empleo de PAs en la elaboración de una FM no siempre
es factible por no estar disponibles, condiciona la ela-
boración de las mismas utilizando medicamentos fabri-
cados industrialmente para los que sí existe un mayor
número de procedimientos validados. Hay que seña-
lar que cualquier cambio en un procedimiento requiere
una nueva validación del mismo por las modificaciones
en las propiedades físicas, químicas o de otros factores
que pudieran producirse.
La ausencia de procedimientos validados para ela-
borar FMs a partir de PAs, junto con la limitación para
solicitar el uso “off-label” de medicamentos en aten-
ción primaria, obstaculizan la preparación en la OF de
FMs prescritas en el ámbito hospitalario, lo que dificulta
en gran medida la accesibilidad al tratamiento pediá-
trico al alta hospitalaria. De ello se deduce la importan-
cia de la colaboración entre los Servicios de Farmacia
de hospitales y las OFs
(32)
. En este sentido, y comen-
tado a modo de ejemplo, en el hospital infantil Virgen
del Rocío de Sevilla facilita un “pack” a los pacientes
que reciben el alta hospitalaria que sirve de gran ayuda
y que incluye: jeringas y adaptadores para la adminis-
tración, información escrita sobre prospecto, PNT de
elaboración para la OF, hoja de dispensación con do-
sificación en ml e instrucciones administrativas para el
paciente y el pediatra, información oral y teléfono de
contacto
(32)
.
Excipientes
Los excipientes, considerados sustancias inactivas,
se añaden a los PAs para posibilitar la preparación del
medicamento, ayudando a modificar las propiedades
organolépticas del fármaco y/o mejorar la biodisponibi-
lidad del producto final. No obstante, excipientes que
son seguros en adultos pueden ser críticos en niños,
especialmente en recién nacidos, debido a la insufi-
ciente capacidad metabólica durante el primer mes de
vida, a diferencias en el aclaramiento renal, a la baja fil-
tración glomerular o a la barrera hematoencefálica más
porosa que presentan
(13)
. Además de neonatos, los ni-
ños enfermos de fibrosis quística, asmáticos, alérgicos
o con trastornos metabólicos (celíacos, diabéticos…)
constituyen grupos de pacientes más vulnerables a de-
terminados excipientes
(33)
. Ya desde 1985 el Comité de
Medicamentos de la Academia Americana de Pediatría
(AAP) recomendó a la FDA (Food and Drug Adminis-
tration) que en el etiquetado se incluyera la relación de
excipientes, debido al incremento de efectos adversos
asociados a los mismos
(34,35)
.
Por todo lo expuesto, hay que tener en cuenta que
en la población pediátrica podemos encontrar limita-
ciones respecto a los excipientes a emplear al elabo-
rar una FM. Así, hay que tener especial precaución en
el empleo de mentol o sulfitos en enfermos de fibrosis
quística, sulfitos y cloruro de benzalconio en neonatos
y enfermos con patologías pulmonares, lactosa o saca-
rosa en enfermos con intolerancia a las mismas, o almi-
dón en pacientes celíacos, por citar algunos ejemplos
(34, 35, 36)
. La Tabla III recoge un resumen de excipientes
críticos en pediatría
(36)
.
Finalmente señalar que los saborizantes empleados
en las FMs pediátricas suelen restringirse a esencias
de fresa alimentaria, menta, anís o vainilla, aunque, en
ocasiones, pueden también emplearse aromas incolo-
ros de manzana, sandía, etc.
(22)
.
Caducidad
Una de las características de las FMs es su prepa-
ración extemporánea. La fecha de caducidad de las
FMTs y los POs se establecerán de acuerdo con la ca-
ducidad que figure en la monografía correspondiente
del Formulario Nacional. Para el resto de FMs existen
diversas recomendaciones, como por ejemplo, las ba-
sadas en la forma farmacéutica elaborada y teniendo
en cuenta que la temperatura adecuada de conser-
vación ha de ser inferior a 25ºC, con las excepciones
que se establezcan (refrigeración, protección de la luz,
etc.…) (Tabla IV),
(37)
.
Tabla IV: Recomendaciones sobre las
caducidades de las Fórmulas Magistrales
Forma farmacéutica FM
Caducidad
CHAMPÚS
3 meses
EMULSIONES en tarro con conser-
vante
3 meses
EMULSIONES en tubo con conser-
vante
6 meses
ENEMAS
6 meses
GELES sin conservante en tubo
(hidroalcohólico)
6 meses
GOTAS NASALES
3 meses
GOTAS ÓTICAS estériles acuosas
1 mes
PAPELES, SELLOS
6 meses
POMADAS ANHIDRAS
6 meses
POMADAS OFTÁLMICAS acuosas
1 mes
POMADAS OFTÁLMICAS anhidras
6 meses
SOLUCIONES VÍA ORAL sin
conservantes
14 días
SOLUCIONES USO EXTERNO sin
conservante
14 días
SUPOSITORIOS
6 meses
SUSPENSIONES sin conservantes
14 días
Además de estas recomendaciones, es importante
indicar que las FMs que contengan alguno de los si-
guientes PAs deberán tener un período de caducidad
máximo de un mes, debido a la inestabilidad de los
mismos: ácido ascórbico, ácido azelaico, ditranol, es-
38
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
Tabla III. Excipientes con riesgo de toxicidad elevada en pediatría
(Breitkreutz J y Boos J. J Exp Opin Drug Deliv 2007; 4: 37-45)
Excipiente
Administración
Reacción Adversa
Prematuros, neonatos, niños < 6 años
Alcohol bencílico
Oral, parenteral
Neurotoxicidad, acidosis metabólica
Etanol
Oral, parenteral
Neurotoxicidad
Polietilenglicol
Parenteral
Acidosis metabólica
Polisorbato 20 y 80
Parenteral
Fallo renal y hepático
Propilenglicol
Oral, parenteral
Convulsiones, neurotoxicidad, hiperosmolaridad
Niños con desórdenes metabólicos
Aspartamo
Oral
Fenilcetonuria
Fructosa
Oral, parenteral
Intolerancia hereditaria a la fructosa
Lactosa
Oral
Intolerancia a la lactosa, diarrea
Sorbitol
Oral
Intolerancia hereditaria a la fructosa
Azúcar
Oral, parenteral
Intolerancia hereditaria a la fructosa
Niños con insuficiencia renal
Sales de aluminio
Oral, parenteral
Encefalopatía, anemia macrocítica, osteodistrofia
Polietilenglicol
Parenteral
Acidosis metabólica
Propilenglicol
Oral, parenteral
Neurotoxicidad, hiperosmolaridad
Hipersensibilidad
Colorantes azoicos
Oral
Urticaria, broncoconstricción, angioedema
Cloruro de benzalconio
Oral, nasal, ocular
Broncoconstricción
Clorocresol
Parenteral
Reacciones anafilácticas
Dextrano
Parenteral
Reacciones anafilácticas
Aceite de ricino polio-
xietilenado
Parenteral
Reacciones anafilácticas
Parabenes
Otal, parenteral, ocular, tópico Alergias, dermatitis de contacto
Ácido sórbico
Tópico
Dermatitis de contacto
Almidón
Oral
Celiaquía
Sulfitos, bisulfitos
Oral, parenteral
Ataques asmáticos, rash,
pironolactona, hidroquinona, isotretinoína, ketocona-
zol, permanganato potásico, tretinoína, peróxido de
urea y vitamina E.
Etiquetado
Se utilizarán los modelos de etiquetado establecidos
en el Formulario Nacional vigente. Los caracteres de-
berán ser legibles e indelebles y como mínimo, se in-
dicarán:
» Denominación del preparado
» Composición cualitativa y cuantitativa, al menos,
de los PAs y de los excipientes de declaración
obligatoria.
» Vía de administración (si puede haber confusión).
» Nº registro en el libro de recetario de la OF o Ser-
vicio de Farmacia (excepto con POs).
» Nª lote, en el caso de POs.
» Fecha de elaboración y validez/caducidad.
» Identificación de la OF/Servicio de Farmacia dis-
pensador.
Información al paciente.
En el ámbito pediátrico se hace aún más impres-
cindible una información adecuada a los padres o fa-
miliares del paciente. Así, deben comprender perfec-
tamente la dosis que deben administrar al niño, expli-
cando cómo viene establecida (mg/kg, mililitros, cen-
tímetros cúbicos…). Al mismo tiempo, y aunque se

39
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
especifique en el etiquetado, el farmacéutico debe ase-
gurar que se transmiten adecuadamente las normas de
conservación y utilización de la FM (frigorífico, agitar an-
tes de usar, etc.…). También se debe asegurar que se
transmiten las posibles reacciones adversas así como
la importancia del cumplimiento terapéutico. La Figura
2 muestra un ejemplo de documento de información
al paciente a entregar cuando se dispensa una FM de
enalaprilo solución a una concentración de 1 mg/ml
(30)
.
Figura 2: Ejemplo de documento de información al
paciente.
Comunicación médico-farmacéutico
La labor de los distintos agentes sanitarios está diri-
gida al bien del paciente, en este caso el niño, principal-
mente a la prevención y la curación de enfermedades.
Sin embargo, son muy numerosas las situaciones en
las que la falta de comunicación entre estos profesio-
nales sanitarios hace difícil alcanzar dicho objetivo
(38)
.
La actuación coordinada de los distintos profesionales
sanitarios es esencial para garantizar la continuidad de
la atención y optimizar la farmacoterapia. Precisamente
en la actualidad, uno de los retos fundamentales en el
ámbito sanitario es conseguir una verdadera integra-
ción de todos los agentes de la salud, constituyendo
auténticos equipos en los que cada profesional pueda
aportar de manera coordinada sus conocimientos y
habilidades
(39)
. Por este motivo resulta de gran impor-
tancia promover encuentros entre pediatras y farma-
céuticos en los que se expongan las preocupaciones,
circunstancias o dudas que rodean la actuación en el
acto sanitario con objeto de conseguir un canal de co-
municación consensuado y fluido entre ellos que re-
dunde en beneficio del paciente. De esa comunicación
se desprende la importancia del seguimiento clínico y
farmacológico al niño al que se prescribe una nueva
FM para poder asegurar tanto su eficacia como su
seguridad
(40)
.
Financiación
Los pacientes pediátricos al alta hospitalaria que
precisan tratamiento con FMs se encuentran con la
dificultad del costo del preparado. La financiación de
las FMs por las distintas entidades del Sistema Nacio-
nal de Salud (SNS) viene establecida en los diferentes
conciertos nacionales y autonómicos. Tanto en Anda-
lucía como en Extremadura, los conciertos respectivos
recogen listados específicos de PAs y excipientes for-
mulables con cargo al SNS y establecen para muchos
de ellos condiciones específicas de financiación (vía de
administración definidas, dosis determinadas, etc.…).
No obstante, ante solicitudes razonadas por parte
de los profesionales sanitarios implicados, se pueden
aportar sugerencias para la inclusión, exclusión o mo-
dificación de PAs en dichos listados. En la actualidad,
esta vía es utilizada por numerosos pediatras para con-
seguir la financiación de FMs concretas en niños.
Comentarios y Conclusiones
La paulatina revalorización de la formulación ma-
gistral viene justificada por razones de tipo farmacoló-
gico, al permitir cubrir lagunas terapéuticas tales como
dosificaciones no registradas, formas farmacéuticas
no existentes, medicamentos con tiempo de caduci-
dad muy breve o que dejan de fabricarse por razones
no sanitarias. Paralelamente, permite personalizar tra-
tamientos, asociando en la misma FM otros PAs que
se consideren necesarios, ajustando la dosis del PA o
seleccionando en cada estadio el excipiente más ade-
cuado mientras se sigue la evolución de la enfermedad.
Asimismo, evita la automedicación, ya que, además de
requerirse receta médica para su elaboración y dispen-
sación, al prepararse la cantidad exacta de medica-
mento necesaria para completar el tratamiento, no de-
ben quedar restos en los hogares. Todo ello repercute
en una atención más individualizada y personalizada a
los pacientes, mejorando los vínculos con él y sus fami-
liares y revalorizándose el papel del pediatra
(41)
.
La formulación magistral pediátrica es una necesi-
dad diaria que no puede suplirse con otros medios.
Por este motivo, se hace necesario unificar criterios a
fin de consensuar procedimientos validados para las
distintas fórmulas magistrales, establecer mecanismos
ágiles que permitan el empleo medicamentos fabrica-
dos industrialmente así como considerar autorizados
en España sustancias que ya lo están en otros países

40
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
europeos. Todas estas medidas facilitarán la continui-
dad del tratamiento terapéutico de los pacientes al alta
hospitalaria.
Por otra parte, es precisa la colaboración entre Aso-
ciaciones, Colegios Profesionales, Distribuidores y Uni-
versidades para potenciar la formulación magistral, y,
en este mismo sentido, debe existir un trabajo conjunto
entre pediatras, farmacéuticos de hospital y farmacéu-
ticos comunitarios. La Universidad debiera incluir en
sus planes de estudios una formulación magistral con
una concepción cada vez más moderna y más cen-
trada en el paciente. Se debe dar difusión a las fórmu-
las magistrales entre los profesionales así como pro-
mover la realización de ensayos clínicos en niños, tanto
en medicina fetal, como neonatal y en las diversas eda-
des, formando, además, pediatras con buenos conoci-
mientos en farmacología clínica pediátrica.
Finalmente, es importante recordar que se precisa
una financiación pública para potenciar la plataforma
española CAIBER con una red pediátrica española de
ensayos clínicos a partir de la red SAMID. La sensibi-
lización de la opinión pública es muy importante para
facilitar los ensayos clínicos en niños. Todo ello nos lle-
varía, en último término, a la verdadera Plataforma In-
ternacional de Farmacología Pediátrica.
Fuentes de Información
? Libros:
– FORMULARIO NACIONAL. Ministerio de Sanidad,
Servicios Sociales e Igualdad. Madrid, 1 ª Ed. y ac-
tualización; 2007.
– REAL FARMACOPEA ESPAÑOLA. Ministerio de
Sanidad, Servicios Sociales e Igualdad. Madrid, 4ª
Ed.; 2010 (suscripción electrónica).
– FORMULARIO BÁSICO DE MEDICAMENTOS MA-
GISTRALES. Llopis Clavijo MJ y Bauxali Comes V.
Distribuciones El Cid. Valencia, 3ª Ed.; 2009.
– FORMULARIO REGIONAL. Colegio Oficial de Far-
macéuticos de Murcia. 2ª Ed.; 2008.
– FORMULACIÓN EN FARMACIA PEDIÁTRICA.
Atienza Fernández M, Martínez Atienza J y Alvarez
del Vayo C. A. Madrid Vicente ediciones. Madrid.
4ª Ed., 2011.
– FÓRMULAS MAGISTRALES EN PEDIATRÍA. Ca-
llabed J. Acofarma Distribución. Barcelona, 2 ª
Ed.; 2011.
– MONOGRAFÍAS FARMACEÚTICAS. Colegio Ofi-
cial de Farmacéuticos de Alicante. 2 ª Ed., 1998.
– FORMULACIONES DE MEDICAMENTOS PARA
PACIENTES CON DIFICULTAD DE DEGLUCIÓN.
Farmacia Hospitalaria de Leganés.1ª Ed.; 2005.
– PEDIATRIC DOSAGE HANDBOOK. Takemoto C.
15º Ed.; 2008
– FORMULARIO PEDIÁTRICO. Elhinhey L. Hospital
Infantil Clarion. Health Partners Inc. Indianapolis,
USA.
– PEDIATRICS DRUG FORMULATIONS. Nahata M.
Harvey Whitney. Cincinnati, 5ª Ed.; 2003
– NEOFAX 2007 y 2008. Thomas J, Young MD.
– etc…
? Revistas:
– De Farmacia Hospitalaria: Farmacia Hospitalaria,
American Journal of Hospital Pharmacy.
– De la Organización Colegial: PAM, Farmacéuticos,
boletines de información…
– De Cooperativas y distribuidores: Acofarma, He-
fame, Cecofar, Fagron…
– Independientes: Farmacia Profesional, El Farma-
céutico, Offarm…
– International Journal of Pharmaceutical Com-
pounding.
– American Journal of Health System Pharmacy.
– Journal of the American Pharmaceutical Associa-
tion.
– The Pharmaceutical Journal.
– Farmacotecnia.
– etc…
? Internet:
Real Farmacopea Española. 4ª edición 2010 (https://
tienda.boe.es/Farmacopea_index.html).
– www.compoundingtoday.com
– www.sefh.es
– www.sickkids.ca
– www.acofarma.com
– www.fagron.es
– www.manuelaatienza.es
– www.aeped.es/cmed
– www.ema.europa.eu
– www.eupfi.org
– www.clinicaltrialregister.eu
– www.clinicaltrials.gov
– www.dec-net.org
– www.ecrin.org
– www.espr.info/Pages/default.aspx
– www.caiber.net
– www.redsamid.net
– www.rdlearning.org.uk
– www.scotmcn.org
– www.mcrn.nl
– www.spectrumrx.com
– www.micromedex.com
– www.martindale.com
– etc…

41
Volumen XIX Nº 1 Abril 2012
F
ORMULACIÓN
MAGISTRAL
EN
PEDIATRÍA
? Listado de siglas:
– AAP: Academia Americana de Pediatría.
– AEMPS: Agencia Española de Medicamentos y
Productos Sanitarios.
– AEP: Asociación Española de Pediatría.
– BPCA: Best Pharmaceuticals for Children Act.
– EC : Ensayos Clínicos.
– EMA: Agencia Europea del Medicamento.
– EuPFI: European Pediatrics Formulation Initiative.
– FDA: Food and Drug Administration.
– FM: Fórmula Magistral.
– FMT: Fórmula Magistral Tipificada.
– GRIP: Global Research in Paediatrics.
– OF: Oficina de Farmacia.
– OMS: Organización Mundial de la Salud.
– PA: Principio Activo.
– PIP: Planes de Investigación Pediátricos.
– PNT: Procedimiento Normalizado de Trabajo.
– PO: Preparado Oficinal.
– SNS: Sistema Nacional de Salud.
Bibliografía
1. Consejo General de Colegios Oficiales de Farma-
céuticos. La Formulación Magistral en España: Una
opción de futuro. Madrid; 2010. Disponible con acceso
privado en: http://pfarmals.portalfarma.com:8080/for-
mulacion_magistral/index.htm.
2. Shirkley H. Therapeutic orphans. J Pediatr 1968;
72:119-20.
3. Nahata MC, Allen LV. Medicamentos no dispo-
nibles en una forma de dosificación adecuada para
niños. Clinical Therapeutics 2008; 30: 2112-19.
4. Cameán Fernández M. Formulación magistral
pediátrica en hospitales. Presentado en el I Symposium
Rafael Alvarez Colunga. Formulación Magistral Pediá-
trica. Unificación de criterios. 16 Abril 2009, Sevilla.
5. Muro Brussi M. Ensayos clínicos en niños. Nuevo
Real Decreto, viejos conceptos. An Pediatr (Barc) 2004;
61: 387-9.
6. Stephenson T. How children´s responses to drugs
differ from adults. Br J Clin Pharmacol 2005; 59: 670-3.
7. Turner S, Longworth A, Nunn AJ, Choonara I. Unli-
censed and off-label drug used in paediatrics wards:
prospective study. Br Med J 1998; 316:343-5.
8. Lesar TS. Errors in the use of medication dosage
equations. Arch Pediatr Adolesc Med 1998; 152: 340-44.
9. Walsh KE, Kaushal R y Chessare JB. How to avoid
paediatric medication errors: a user´s guide to the lite-
rature. Arch Dis Child 2005; 90: 698-702.
10. Feal BC, Barroso PJ, Carcelén AC y Fábrega B.
Utilización de medicamentos en unidades de neonato-
logía de 6 hospitales españoles. Farmacia Hospitalaria
2003; 27 (2): 17-19.
11. Conroy S, Choonara I, Impicciatore P, Mohn A,
Arnell H, Rane A et al. Survey of unlicensed and off-label
drug used in paediatrics wards in European countries.
European Network for drug investigation in children. Br
Med J 2000; 320: 79-82.
12. Choonara I, Conroy S. Unlicensed and off-label
drug used in children: implications for safety. Drug
Safety 2002; 25 (1): 1-5.
13. Winzenburg G. Current issues in pediatric devel-
opment. Presentado en el II Symposium Rafael Alvarez
Colunga. Formulación Magistral Pediátrica. Unificación
de criterios. Avances y nuevas perspectivas. 29 Abril
2010, Sevilla.
14. Valls-i-Soler A, Santesteban E y Campino A.
Mejores medicamentos en pediatría. An Pediatr (Barc)
2011; 75 (2): 85-88.
15. Collins FS. Best Pharmaceuticals for Children
Act. (BPCA). Priority List of Needs in Pediatrics Thera-
peutics. Federal Register 2001; 76:18228-9.
16. European Medicines Agency. Medicines for chil-
dren, 26 Enero 2007.
17. Organización Mundial de la Salud. Nueva lista de
medicamentos esenciales, 26 Abril 2007.
18. Le Barbier C. Quality Evaluation of Paediatric
Investigation. Presentado en el II Symposium Rafael
Alvarez Colunga. Formulación Magistral Pediátrica.
Unificación de criterios. Avances y nuevas perspec-
tivas. 29 Abril 2010, Sevilla.
19. Danés Carreras I, Fuentes Camps I, Arnau de
Bolos JM, Pandolfini C, Bonati M, Sammons H et al.
Un registro europeo de ensayos clínicos en niños. An
Pediatr (Barc) 2004; 60: 212-14.
20. Memoria de actividades. Comité de Ensayos Clí-
nicos en Andalucía. Marzo 2009, Antequera (Málaga).
21. Peiré García MA. Importancia de la farmacología
clínica en Pediatría. An Pediatr (Barc) 2010; 72 (2):
99-102.
22. Manzanares Olivares JM. Formulación magistral
pediátrica en la oficina de farmacia. Presentado en
el I Symposium Rafael Alvarez Colunga. Formulación
Magistral Pediátrica. Unificación de criterios. 16 Abril
2009, Sevilla.
23. Amor Ruíz IM, Gallego Fernández C, Delgado Rey
MS, Morillo Mora AB y González Muñiz V. Utilización de
medicamentos huérfanos en pediatría. Presentado en
el 52º Congreso de la Sociedad Española de Farmacia
Hospitalaria. 25-28 Septiembre 2007, Arona (Tenerife).
24. Brion F, Nunn AJ y Rieutord A. Extemporaneous
(magistral) preparation of oral medicines for children in
European hospitals. Acta Paediatr 2003; 92 (4): 486-490.
25. Atienza Fernández M. Consecuencias de la apli-
cación de la normativa sobre la Formulación Magistral.
Problemática de la Formulación Pediátrica. Presentado

42
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
en el 59º Congreso de la Sociedad Española de Far-
macia Hospitalaria. Octubre 2004, Huelva.
26. Glass BD y Haywood A. Stability consideration in
liquid dosage forms extemporaneously prepared from
commercially available products. J Pharm Pharmaceut
Sci 2006; 9 (3): 398-426.
27. I Symposium Rafael Alvarez Colunga. Formula-
ción Magistral Pediátrica. Unificación de criterios. 16
Abril 2009, Sevilla.
28. II Symposium Rafael Alvarez Colunga. Formu-
lación Magistral Pediátrica. Unificación de criterios.
Avances y nuevas perspectivas. 29 Abril 2010, Sevilla.
29. III Symposium Rafael Alvarez Colunga. Formula-
ción Magistral Pediátrica. Unificación de criterios. For-
mulaciones estables y nuevos campos. 29 Abril 2011,
Sevilla.
30. Atienza Fernández M, Martínez Atienza J y
Alvarez del Vayo C. Formulación en farmacia pediátrica.
Madrid: A. Madrid Vicente ediciones; 2011.
31. Atienza Fernández M y Martínez Atienza J.
Uso de especialidades en la formulación. Problemas
legales. Presentado en el I Symposium Rafael Alvarez
Colunga. Formulación Magistral Pediátrica. Unificación
de criterios. 16 Abril 2009, Sevilla.
32. Alvarez del Vayo C. Farmacia hospitalaria y for-
mulación pediátrica: necesidades y realidades. Pre-
sentado en el I Symposium Rafael Alvarez Colunga.
Formulación Magistral Pediátrica. Unificación de crite-
rios. 16 Abril 2009, Sevilla.
33. Whittaker A, Mulla H, Turner MA, Currie AE, Filed
DJ y Pandya HC. Toxic additives in medications for pre-
term infants. Arch Dis Child Fetal Neonatal 2009; 94 (4):
F236-40.
34. American Academy of Pediatrics. Commitee on
Drugs. “Inactive” ingredients in pharmaceutical pro-
ducts. Pediatrics 1985; 76: 635-43.
35. American Academy of Pediatrics. Commitee on
Drugs. “Inactive” ingredients in pharmaceutical pro-
ducts: update (subject review). Pediatrics 1997; 99:
268-78.
36. Breitkreutz J y Boos J. Excipientes with elevated
toxicological risk for subpopulations of paediatrics and
geriatrics patients. J Exp Opin Drug Deliv 2007; 4:
37-45.
37. Colegio Oficial de Farmacéuticos de la Región de
Murcia. Formulario Regional. Murcia; 2005.
38. Consejo de Farmacéuticos del País Vasco.
Canales de comunicación efectivos entre los pro-
fesionales de los Centros de Salud y las Oficinas de
Farmacia de su área de influencia. Boletín Terapeútico
Sendagaiak 2007; 20 (4).
39. López Guzmán J. El farmacéutico y el equipo
de salud: un nuevo paradigma de relaciones interpro-
fesionales. Pharmaceutical Care España 2009; 11 (2):
85-89.
40. Oliveras Arenas M. Cambios de forma farmacéu-
tica y vía de administración. Iniciativas, criterios y alter-
nativas, control de eficacia y seguridad. Presentado en
el I Symposium Rafael Alvarez Colunga. Formulación
Magistral Pediátrica. Unificación de criterios. 16 Abril
2009, Sevilla.
41. Callabed J. Prescripción magistral en pediatría.
FAGRON 2010; nº 1.
| Adjunto | Tamaño |
|---|---|
| voxpaed19.1pags30-42.pdf | 782.27 KB |



