![]()
Las RAS-patias
Los conocimientos recientes en genética molecular han originado la definición de un nuevo grupo de síndromes genéticos congénitos originados por mutaciones germinales en genes que codifican componentes o moduladores de la vía RAS/proteína kinasa activada por mitógeno (MAPK), denominados genéricamente alteraciones de la vía RAS/MAPK, síndromes neuro-facio-cardio-cutáneos o RAS-patías.Estos síndromes incluyen el relativamente frecuente síndrome de Noonan, la neurofibromatosis tipo 1, el síndrome de Legius, el síndrome de Noonan con lentigos múltiples, el síndrome malformación capilar-malformación arteriovenosa, el síndrome cardio-facio-cutáneo y el síndrome de Costello. Globalmente son uno de los grupos más amplios de síndromes malformativos con una frecuencia aproximada de 1/1.000 recién nacidos. Debido a su mecanismo patogénico común, la desregulación de la vía RAS/MAPK, estos síndromes comparten manifestaciones clínicas que se solapan e incluyen fenotipo craneofacial característico; cardiopatía; anomalías cutáneas, musculoesqueléticas y oculares; retraso de crecimiento y psicomotor; y predisposición a tumores. Los recientes avances en la identificación del espectro de mutaciones en los genes y las manifestaciones clínicas asociadas han definido correlaciones genotipo-fenotipo, importantes para el manejo clínico de estos pacientes. Actualmente se están realizando ensayos clínicos con fármacos que reducen la actividad RAS/MAPK con el fin de disminuir la progresión de los signos y síntomas asociados a estos síndromes.
The recent knowledge in molecular genetics have led to the definition of a new group of congenital genetic syndromes caused by germline mutations in genes that encode components or regulators of the RAS/mitogen-activated protein kinase (MAPK) pathway, known under the term RAS/MAPK pathway disorders, neuro-facial-cardial-cutaneous disorders, or RASopathies. The group comprises the relatively common Noonan syndrome, neurofibromatosis type 1, Legius syndrome, Noonan syndrome with multiple lentigines, capillary malformation-arteriovenous malformation syndrome, cardio-facio-cutaneous syndrome, and Costello syndrome. Taken together, they are one of the largest known groups of malformation syndromes with an approximately frequency of 1 in 1,000 newborns. Because of the common underlying RAS/MAPK pathway dysregulation, these syndromes share numerous overlapping phenotypic features comprising characteristic facial features; cardiac defects; cutaneous, musculoskeletal, and ocular abnormalities; growth retardation, neurocognitive delay and predisposition to malignancies. The increasing advances about the gene mutations spectrum and associated clinical manifestations have led to a better knowledge of genotype-phenotype correlations, important data for the clinician. Medical treatment approaches using molecules to reduce RAS/MAPK activity in the RASopathies are under way, in order to ameliorate the progression of signs and symptoms of these disorders.
47
Volumen XXI Nº 1 Mayo 2014
A
RROYO
C
ARRERA
I.
ET
AL
- L
AS
RAS
-
PATIAS
Introducción
Durante los últimos años los avances genéticos han
permitido definir un nuevo grupo de síndromes malfor-
mativos congénitos, ya identificados clínicamente, y
originados todos ellos por mutaciones germinales en
genes de la vía RAS/MAPK
1-8
.
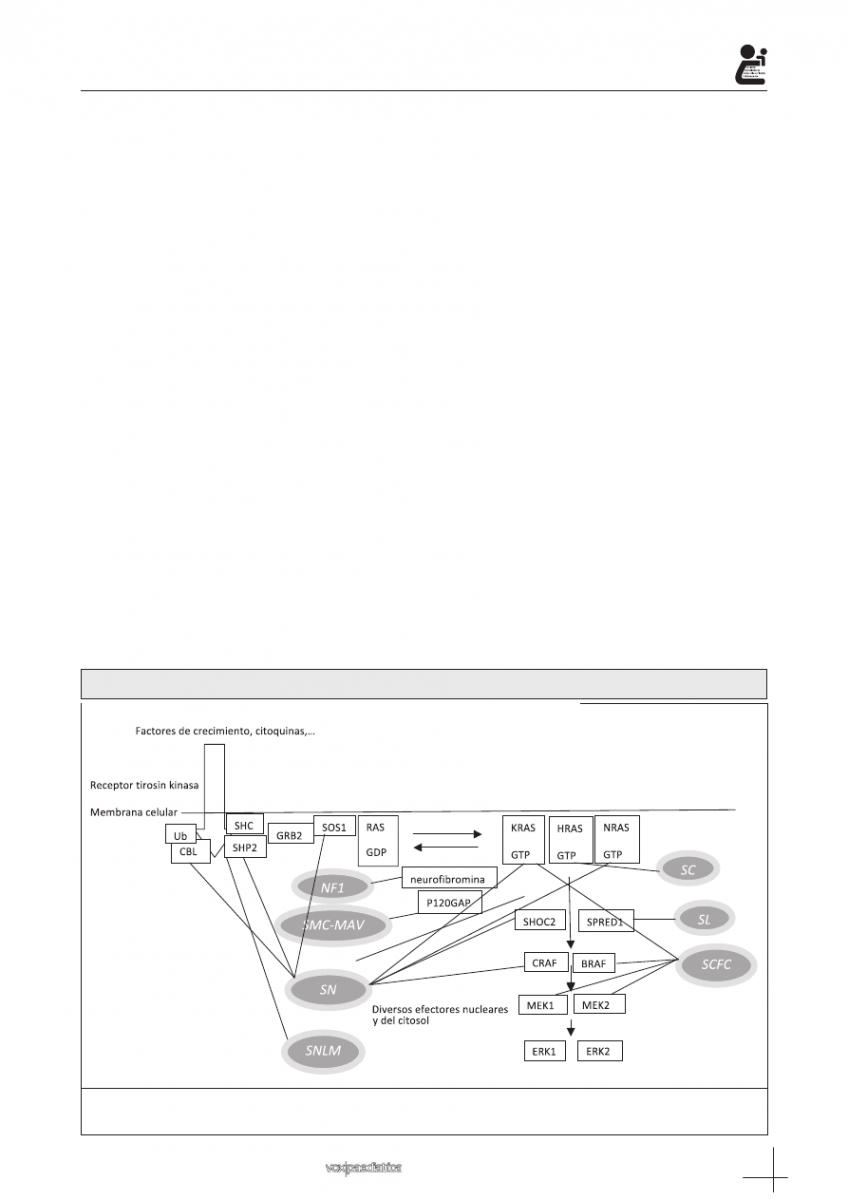
La vía RAS/MAPK es una de las vías de señaliza-
ción celular más importante. Está implicada en la regu-
lación del ciclo celular, su proliferación, migración, dife-
renciación, apoptosis y senescencia, todo ello esencial
para el desarrollo animal. Los genes RAS son una fa-
milia que incluye HRAS, NRAS y KRAS. Las proteínas
Ras actúan como llaves, se activan por factores de cre-
cimiento extracelulares y alternan entre una forma ac-
tiva unida a GTP, y una forma inactiva unida a GDP. En
esta activación interviene también GRB2 y SOS. Este
balance entre activación/inactivación está regulado con
gran precisión. La vía MAPK es una de las cascadas de
señalización celular de Ras, caracterizada por su re-
dundancia molecular con diferentes isoformas codifi-
cadas por genes distintos. Las proteínas Ras activadas
originan la activación de Raf (ARAF, BRAF y/o CRAF).
La primera kinasa MAPK de la vía, Raf se fosforila y
activa las kinasas MEK1 y/o MEK2, que a su vez fos-
forila y activa ERK1 y/o ERK2, las últimas efectoras de
la vía que ejercen su función sobre un amplio número
de sustratos, tanto del núcleo como del citosol, vitales
para diversas funciones celulares, entre ellas la expre-
sión génica
1-4,9
(Figura 1).
La vía RAS/MAPK ha sido ampliamente estudiada
en oncogénesis porque las mutaciones somáticas en
KRAS y BRAF son una de las alteraciones genéticas
más frecuentes observadas en un amplio número de
cánceres
10
. Los genes RAS y RAF son proto-oncoge-
nes, por ello una de las manifestaciones clínicas de las
RAS-patías es su predisposición al desarrollo de tumo-
res
11-12
. Sin embargo, con pocas excepciones, las mu-
taciones somáticas encontradas en tumores son distin-
tas a las germinales de los pacientes con RAS-patías.
La desregulación de la vía originada por las mutaciones
somáticas es mucho mayor que la originada por las
germinales, y se piensa que estas mutaciones encon-
tradas en los tumores son letales si ocurren en la línea
germinal
13
.
Los diferentes síndromes incluidos en las RAS-patías
Globalmente los síndromes por desregulación de la
vía RAS/MAPK son uno de los grupos más amplios en
número y frecuencia de los síndromes malformativos
afectando a 1 de cada 1.000 recién nacidos. La neuro-
fibromatosis tipo 1 (NF1) fue el primer síndrome cuya
causa fue identificada en una mutación en heterocigo-
sis en un gen de la vía
14
, posteriormente se han identifi-
cado el síndrome de Noonan
15
(SN) y otros.
Todas las RAS-patías presentan un patrón fenotípico
común aunque las manifestaciones individuales pue-
den variar ampliamente en su expresión entre los di-
ferentes síndromes. Las manifestaciones clínicas más
importantes son cardiopatía, talla baja y fenotipo cra-
Figura 1: Vía metabólica RAS/MAPK y síndromes genéticos asociados a su alteración
(NF1 = neurofibromatosis tipo 1. SMC-MAV = síndrome de malformación capilar-malformación arteriovenosa.
SN = síndrome de Noonan. SNLM = síndrome de Noonan con lentígines múltiples. SC = síndrome de Costello.
SL = síndrome de Legius.SCFC = síndrome cardio-facio-cutáneo)

48
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
neofacial característico
1-8
. Las cardiopatías más fre-
cuentes son estenosis valvular pulmonar asociada fre-
cuentemente a displasia de la válvula, cardiomiopatía
hipertrófica y defectos del tabique atrioventricular. El
patrón de crecimiento se caracteriza por antropome-
tría normal o ligeramente disminuida al nacimiento con
caída postnatal y dificultad para la alimentación. El perí-
metro cefálico está habitualmente aumentado con ma-
crocefalia absoluta o relativa. Las manifestaciones cra-
neofaciales incluyen frente ancha, hipertelorismo, hen-
diduras palpebrales con inclinación hacia abajo, ptosis
palpebral, pabellones auriculares de implantación baja
rotados posteriormente y cuello ancho/pterigium. Es-
tas manifestaciones en muchas ocasiones son poco
expresivas al nacimiento. Otras manifestaciones que
ocurren frecuentemente son anomalías linfáticas como
linfedema o quilotórax, que pueden presentarse prena-
talmente, y debe tenerse en cuenta en el diagnóstico
prenatal (sobre todo el edema nucal/higroma quístico),
fenotipo torácico característico con aumento de la dis-
tancia intermamilar, pectus carinatum superior y exca-
vatum inferior, criptorquidia, anomalías ectodérmicas
que incluyen sequedad cutánea con hiperqueratosis,
pelo ralo, de crecimiento lento, rizado y alteraciones de
la pigmentación, manchas café con leche y lentigos.
También pueden presentar alteraciones oculares (de-
fectos de refracción, estrabismo, nistagmus) y diátesis
hemorrágica por déficit parcial de factores de la coagu-
lación. El retraso motor con hipotonía es frecuente, así
como la afectación cognitiva aunque ésta varía mucho
entre las diferentes RAS-patías. También presentan un
riesgo aumentado de tumores (Tabla I).
Tabla I.- Manifestaciones clínicas comunes de las RAS-patías
Fenotipo craneofacial
Frente ancha , hipertelorismo, aperturas palpebrales con inclinación hacia abajo,
ptosis, pabellones auriculares de implantación baja/rotados posteriormente, cuello
corto, ancho/pterigium colli
Cardiopatía
Estenosis/displasia valvular pulmonar, cardiomiopatía hipertrófica, defectos septales
Alimentación y crecimiento
Dificultades de alimentación, retraso de crecimiento, macrocefalia absoluta o relativa
Genitourinarias
Criptorquidia, anomalías renales menores
Ectodérmicas (piel y anejos)
Hiperqueratosis, pelo ralo, rizado, de crecimiento lento, lesiones hiperpigmentadas
Musculoesquelético
Deformidad torácica: pectus carinatum superior y excavatum inferior, aumento de la
distancia intermamilar, escoliosis
Neurodesarrollo
Hipotonía, dificultad de aprendizaje, retraso mental
Oculares
Defectos de refracción, estrabismo, nistagmus
Linfáticas
Edema nucal fetal, hidrotórax fetal, hidrops, linfedema pre y postnatal
Coagulación
Diátesis hemorrágica por déficit parcial de factores de la coagulación
Predisposición a tumores
Leucemia mielomonocítica juvenil, otros
Tabla II.- Síndromes genéticos de la vía RAS/MAPK (RAS-patías)
Síndrome
Gen de la vía RAS/MAPK
Proteína
Función de la proteína
Noonan
PTPN11
SOS1
RAF1
KRAS
NRAS
SHOC2
CBL
SHP2
SOS1
CRAF
KRAS
NRAS
SHOC2
CBL
Fosfatasa
RasGEF
Kinasa
GTPasa
GTPasa
Andamiaje
E3, ubiquitin ligasa
Neurofibromatosis tipo 1
NF1
Neurofibromina
RasGAP
Legius
SPRED1
SPRED1
SPROUTY-related, EVH1
domain-containing protein 1
Noonan con lentígines
múltiples
PTPN11
RAF1
SHP2
RAF1/CRAF
Fosfatasa
Kinasa
Malformación capilar-malfor-
mación arteriovenosa
RASA1
p120-RasGAP
RasGAP
Cardio-facio-cutáneo
BRAF
MAP2K1
MAP2K2
KRAS
BRAF
MEK1
MEK2
KRAS
Kinasa
Kinasa
Kinasa
GTPasa
Costello
HRAS
HRAS
GTPasa

49
Volumen XXI Nº 1 Mayo 2014
A
RROYO
C
ARRERA
I.
ET
AL
- L
AS
RAS
-
PATIAS
La heterogeneidad genética de las diferentes RAS-
patías es muy amplia con mutaciones descritas en 14
genes de la vía. Un mismo síndrome puede estar origi-
nado por mutaciones en varios genes (por ejemplo se
han identificado 7 en el síndrome de Noonan), y mu-
taciones en un mismo gen pueden originar síndromes
distintos (por ejemplo se han identificado mutaciones en
BRAF en pacientes con síndrome cardio-facio-cutáneo,
Noonan y Noonan con lentigos múltiples)
1-3
(Tabla II).
Los hallazgos genéticos de los últimos años están
permitiendo establecer correlaciones fenotipo-geno-
tipo, entre y dentro de los diferentes síndromes de la
vía, por lo tanto el estudio genético es fundamental
para el diagnóstico diferencial porque nos permitirá es-
timar el pronóstico individual del paciente.
Síndrome de Noonan (OMIM 163950)
Es el síndrome más frecuente de las RAS-patías que
afecta a 1 de cada 1.000-2.000 recién nacidos. Aun-
que su fenotipo es variable se caracteriza por mani-
festaciones craneofaciales que incluyen frente amplia,
hipertelorismo, hendiduras palpebrales con inclinación
hacia abajo, pabellones auriculares de implantación
baja rotados posteriormente y cuello corto y/o alado.
Otras manifestaciones clínicas importantes son cardio-
patía congénita (50-80%), talla baja (67%), y un grado
variable de déficit cognitivo presente en un tercio de
los pacientes (CI medio 80-90). Además presentan un
riesgo aumentado de desarrollar cáncer que en un es-
tudio holandés se ha cuantificado en un aumento de
3,5 veces respecto a la población general
16
. También
pueden presentar alteración de la coagulación, anoma-
lías ectodérmicas, displasias linfáticas y criptorquidia
17
.
El diagnóstico se basa en las manifestaciones clíni-
cas y hemos de tener en cuenta que éstas varían se-
gún la edad del paciente. Al nacimiento los hallazgos
faciales son menos expresivos, la talla suele ser normal
y predominan las manifestaciones linfáticas, linfedema
y cuello ancho alado. El retraso de crecimiento, la de-
formidad torácica y las manifestaciones faciales se ha-
cen evidentes en los primeros años, pero son menos
expresivas posteriormente. Respecto a la talla muchos
pacientes experimentan una recuperación en la adoles-
cencia siendo la talla final normal en el 50% de los ca-
sos sin tratamiento farmacológico
18
. No se ha demos-
trado un patrón anómalo de secreción de hormona de
crecimiento (GH) en la mayoría de los pacientes, por lo
que en el momento actual no está clara la indicación
de tratamiento con GH en aquellos casos sin déficit de-
mostrado de GH.
La variabilidad clínica puede explicarse en parte por
la alteración genética de base. El gen PTPN11 fue el
primer gen causal identificado del SN
15
y es el más fre-
cuente, aproximadamente el 50% de los casos. Actual-
mente se han identificado otros 6 genes causales del
SN, que son: SOS1, RAF1, KRAS, NRAS, SHOC2 y
CBL. Todas las mutaciones identificadas en estos ge-
nes son germinales heterocigotas y codifican varios
componentes o proteínas asociadas de la vía RAS/
MAPK. Las mutaciones en PTPN11 alteran la estabili-
dad de la forma catalítica inactiva de SHP2, afectando
a la habilidad de la proteína para pasar de la conforma-
ción activa a inactiva produciendo un aumento de señal
de la vía RAS/MAPK.
Los pacientes con mutación en PTPN11 tienen más
frecuentemente estenosis pulmonar y menos frecuen-
temente cardiomiopatía hipertrófica
19
, y el sangrado es
más frecuente.
Las mutaciones en SOS1 son las segundas en fre-
cuencia, representando el 15% de los casos. El tipo de
cardiopatía es similar al presente en los pacientes con
mutaciones en PTPN11 pero es menos frecuente la ta-
lla baja y el déficit cognitivo. Las manifestaciones ecto-
dérmicas (pelo rizado, cejas ralas, queratosis) son más
frecuentes y recuerdan a las presentes en el síndrome
cardio-facio-cutáneo
20
. Estas mutaciones alteran la au-
toinhibición de la actividad SOS1 RasGEF originando
una ganancia de función de SOS1 con el aumento sub-
secuente de la forma activa de Ras y aumento de la se-
ñal de la vía RAS/MAPK.
Las mutaciones en RAF1 son responsables de un
5-8% de los casos y están altamente asociadas a la pre-
sencia de cardiomiopatía hipertrófica, en un 80-95%, con
un claro peor pronóstico
21
. Estas mutaciones ocasionan
una ganancia de función de CRAF debido a la fosforila-
ción de los residuos S259 y S621 que regulan CRAF.
Las mutaciones en KRAS representan el 2-3% de
los casos, el fenotipo es muy variable con un mayor
porcentaje de afectación cognitiva
22
. Las mutaciones
en NRAS son < 1% de los casos
23
.
Un grupo de pacientes con SN tienen un fenotipo
de pelo característico, cabello anágeno caduco (OMIM
607721), el pelo es escaso, fino, se rompe fácilmente y
crece despacio. Presentan además una hiperpigmen-
tación difusa cutánea con eczema e ictiosis. El espec-
tro de cardiopatía es distinto con predominio de dis-
plasia de la válvula mitral y defectos septales respecto
a la estenosis pulmonar. Es más frecuente la talla baja
por déficit de GH y el déficit cognitivo con alteración
conductual. Estos pacientes son genéticamente ho-
mogéneos y tienen una misma mutación en SHOC2,
p.S2G, que origina un transporte aberrante de SHOC2
a la membrana celular, la desfosforilación prolongada
de RAF1 y una activación mantenida de la vía MAPK
24
.
Hay otro grupo de pacientes con fenotipo de SN
que han desarrollado leucemia juvenil mielomonocítica
(LJMN) (OMIM 613563) en los que se han identificado
mutaciones germinales en el gen CBL. El fenotipo aso-
ciado a la mutación en este gen incluye talla baja, re-
traso cognitivo, criptorquidia, dismorfia facial, manchas
café con leche y predisposición a LJMN. La existencia
de mutaciones en CBL con penetrancia incompleta, en
padres aparentemente sanos que portan la mutación,
debe implicar una mayor complejidad en el mecanismo
genético que origina el fenotipo
25
.

50
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
Neurofibromatosis tipo 1 (OMIM 162200) y feno-
tipos asociados
La neurofibromatosis tipo 1 (NF1) es una de las en-
fermedades autosómicas dominantes más frecuentes,
y se presenta en 1 de cada 3.000-4.000 recién naci-
dos. Sus manifestaciones clínicas incluyen neurofibro-
mas, manchas café con leche, pecas axilares y/o in-
guinales, nódulos de Lisch, anomalías esqueléticas y
vasculares, alteración neuroconductual, macrocefalia
y predisposición al desarrollo de tumores
26
. El diag-
nóstico basado en criterios clínicos está ampliamente
aceptado (NIH Consensus Development Conference,
1988
27
), aunque estos criterios son menos sensibles y
específicos en niños pequeños.
Está causada por mutaciones con pérdida de fun-
ción o, menos frecuentemente, deleciones del gen
NF1, que codifica la GTPasa RAS-específica, neurofi-
bromina, que se identifican en > 90% de los pacientes.
La NF1 tiene una penetrancia completa pero con una
expresividad variable inter e intrafamiliar.
Existe un grupo de pacientes que cumplen criterios
de NF1 que presentan también un fenotipo caracte-
rístico de SN, estos pacientes se incluyeron en el sín-
drome neurofibromatosis-Noonan (OMIM 601321), y la
mayoría tienen mutaciones en el gen NF1. Hoy en día
se cree que estos pacientes representan el extremo del
espectro de manifestaciones clínicas similares a Noo-
nan en los pacientes con neurofibromatosis, de hecho
los pacientes con NF1 presentan con frecuencia ma-
nifestaciones que solapan con las presentes en el SN,
entre ellas déficit cognitivo, talla baja (20%), cardiopatía
y fenotipo facial. Estas manifestaciones evolutivas que
solapan con el SN reflejan una desregulación leve, pero
generalizada de la vía RAS/MAPK debido a la haploin-
suficiencia originada por la mutación germinal en uno
de los alelos del gen NF1. Sin embargo las lesiones
cutáneas de pigmentación y los tumores típicos que
representan los principales criterios clínicos son el re-
sultado de una pérdida de función somática del 2º alelo
y la expresión clonal de esas células totalmente des-
provistas de la inhibición inducida por neurofibromina
de la vía RAS/MAPK
28-29
.
Síndrome de Legius (OMIM 611431)
El síndrome de Legius presenta manifestaciones
clínicas de la NF1 y de otras RAS-patías. Presentan
manchas café con leche, pecas, retraso cognitivo leve,
macrocefalia y fenotipo craneofacial similar al SN, ge-
neralmente no muy expresivo, pero no presentan las
manifestaciones tumorales frecuentes en la NF1 como
neurofibromas, nódulos de Lisch y tumores del sistema
nervioso central. No tenemos actualmente datos su-
ficientes para saber si estos pacientes presentan un
riesgo elevado de desarrollo de tumores. El síndrome
está originado por mutaciones heterocigotas inactivan-
tes en SPRED1
30
, que codifica un regulador negativo
de la vía RAS/MAPK. Al igual que en la NF1 las muta-
ciones germinales de SPRED1 originan pérdida de fun-
ción sugiriendo que las manifestaciones clínicas simi-
lares a Noonan son originadas por haploinsuficiencia.
Síndrome de Noonan con lentigos múltiples
(OMIM 151100)
Antes denominado por el acrónimo LEOPARD (lenti-
gos múltiples, alteraciones EEG, hipertelorismo ocular,
estenosis pulmonar, anomalía genital, retraso de cre-
cimiento y sordera). Estos pacientes tienen el fenotipo
craneofacial del SN, habitualmente no muy expresivo, y
las otras anomalías asociadas. La aparición de los len-
tigos múltiples comienza habitualmente en la infancia y
aumenta hasta la pubertad donde pueden identificarse
miles. Es frecuente también la aparición de manchas
café con leche (70-80%). La cardiopatía, presente en
aproximadamente el 50% de los pacientes, incluye de-
fectos de conducción progresivos con miocardiopatía
hipertrófica en hasta el 80% de los casos. La sordera
neurosensorial está presente en el 20%. La frecuencia
de talla baja y déficit cognitivo es similar al presente en
el SN
31
.
El síndrome es originado por mutaciones específicas
del gen PTPN11, principalmente p.Y279C y p.T486M,
que tienen un efecto patogénico diferente en la vía al
originar una actividad catalítica disminuida del producto
génico SHP2, aunque el fenotipo no puede explicarse
por una simple pérdida de función por haploinsuficien-
cia
32
. También se han descrito muy infrecuentemente
mutaciones en RAF1 en pacientes con el síndrome.
Síndrome de malformación capilar-malformación
arteriovenosa (OMIM 608354)
Es un síndrome de herencia autosómica dominante
con malformaciones capilares en múltiples localizacio-
nes que pueden asociarse con malformaciones arterio-
venosas y fístulas en múltiples tejidos incluidos órganos
internos, puede asociar cardiopatía y presenta una ma-
yor predisposición al desarrollo de tumores similares a
los de la NF1
33
. Está originado por mutaciones hetero-
cigotas inactivantes de RASA1, un regulador negativo
de la vía RAS/MAPK.
Síndrome cardio-facio-cutáneo (OMIM 115150)
Las manifestaciones clínicas solapan con el SN, del
que se diferencia fundamentalmente por la mayor ex-
presividad de algunas de ellas
6
, principalmente el défi-
cit cognitivo, retraso de crecimiento, alteraciones ec-
todérmicas y el tipo de cardiopatía. La mayoría de los
pacientes presentan retraso mental, leve a profundo, el
50% epilepsia y están descritas malformaciones cere-
brales
34
. Las dificultades de alimentación están presen-
tes en la mayoría de los pacientes de forma muy pre-
coz con reflujo gastroesofágico frecuente que requiere
cirugía. Las anomalías de piel y anejos están presentes
en prácticamente todos los pacientes e incluyen pelo
ralo, rizado con cejas escasas, queratosis y aparición
de hemangiomas y nevus
35
. Las anomalías musculoes-
queléticas y oculares son más frecuentes que en el SN.
Actualmente no hay datos concluyentes respecto al

51
Volumen XXI Nº 1 Mayo 2014
A
RROYO
C
ARRERA
I.
ET
AL
- L
AS
RAS
-
PATIAS
riesgo elevado de tumores en los pacientes con sín-
drome cardio-facio-cutáneo (SCFC) a diferencia del
claramente establecido en la NF1, el SN y el síndrome
de Costello, aunque sí hay casos aislados de pacientes
con leucemia linfoblástica aguda, linfoma no Hodgkin,
hepatoblastoma y neuroblastoma
1,6,11-12
.
Cuatro genes de la vía RAS-MAPK se han identifi-
cado mutados en el SCFC36-37, BRAF (75% de los
casos), MAP2K1 (MEK1) y MAP2K2 (MEK2) (25%) y
KRAS, aunque el papel de KRAS en el SCFC es discu-
tible porque estos pacientes podrían incluirse en el SN.
Síndrome de Costello (OMIM 218040)
Aunque las manifestaciones clínicas solapan con
otras RAS-patías es el síndrome probablemente más
homogéneo de todos ellos, clínica y genéticamente
6
.
El fenotipo craneofacial es muy expresivo en su evolu-
ción con aspecto que recuerda a una enfermedad de
depósito: mejillas llenas, macrostomía con labios pro-
minentes. La piel es blanda, redundante, sobre todo
en el dorso de manos y pies con surcos palmares y
plantares profundos. El pelo es escaso y muy rizado.
Es frecuente la aparición de papilomas cutáneos, en
el 72% de los casos, su localización más frecuente es
perinasal
38
. Las dificultades de la alimentación son gra-
ves y el retraso mental es de grado leve-moderado, la
cardiomiopatía hipertrófica es frecuente
39
. El riesgo de
padecer cáncer es elevado (15-20%), los más frecuen-
tes son el rabdomiosarcoma embrionario, el carcinoma
vesical y el neuroblastoma
40
.
El síndrome de Costello está ocasionado por muta-
ciones germinales heterocigotas activantes en HRAS
41
y más del 80% de los pacientes tienen la misma susti-
tución p.G12S, que condiciona una disminución de la
actividad GTPasa intrínseca e inducida por GAP que
mantiene a RAS en su estado activo.
Conclusiones
Debido a la relativa alta prevalencia de alguno de es-
tos síndromes, sobre todo el SN y la NF1, la desregu-
lación de esta vía de señalización representa una de
las alteraciones más frecuentes que afecta a los proce-
sos del desarrollo. Estos síndromes varían clínicamente
entre fenotipos leves que afectan poco a la calidad
de vida a síndromes gravemente discapacitantes con
mortalidad precoz. Su mecanismo patogénico común
es la desregulación de la vía RAS/MAPK que resulta de
la mutación de múltiples genes, algunos de los cuales
no están todavía identificados. El diagnóstico de todos
estos síndromes sigue siendo el reconocimiento del fe-
notipo clínico. El solapamiento de las manifestaciones
clínicas así como la no existencia de ninguna patogno-
mónica sigue haciendo de él un gran reto para el clí-
nico. El estudio genético no solo nos permitirá la confir-
mación clínica y asesoramiento genético sino que nos
ofrecerá información sobre el pronóstico y el manejo
clínico, que debe ser realizado por un equipo multidis-
ciplinar. Existen en la literatura recomendaciones para
el seguimiento de estos pacientes
17,42-43
. La mayor des-
cripción de casos con estudio genético nos permitirá
tener una mejor correlación genotipo-fenotipo.
El mejor conocimiento de los mecanismos genéti-
cos implicados ha permitido trasladar estos hallazgos
al posible tratamiento que pueda compensar la desre-
gulación de la vía. Existen ya estudios animales y mo-
delos in vitro con respuestas prometedoras en la fun-
ción cognitiva
44
y la cardiomiopatía hipertrófica
45
. Los
resultados del primer ensayo clínico en humanos, alea-
torizado, controlado con placebo, doble ciego, evalúa
el efecto de 12 semanas de tratamiento con simvasta-
tina, un inhibidor enzimático que interfiere en la vía de
biosíntesis del colesterol y también en la isoprenilación
de Ras disminuyendo su actividad, en la función cog-
nitiva en niños con NF1. Los resultados han sido nega-
tivos no mejorando la función cognitiva
46
. Otro ensayo
clínico ha evaluado el tratamiento con lovastatina en ni-
ños con NF1. Este ha demostrado mejoría significativa
en la memoria verbal y no verbal, atención y eficiencia
visual
47
. Actualmente se está desarrollando un ensayo
clínico fase II en pacientes con SN. Otro ensayo clí-
nico está evaluando el efecto de MEK162, un inhibidor
de MEK, en la reducción de la miocardiopatía hipertró-
fica en adultos con SN que la presentan. Este ensayo
está basado en datos prometedores con animales eva-
luando la respuesta del inhibidor en la disminución de
la activación de la vía RAS/MAPK
48
con la obtención de
mejoría del desarrollo.
El futuro terapéutico, pues, puede estar en el uso de
tratamientos que reduzcan la activación RAS/MAPK en
las RAS-patías y poder así mejorar la progresión de los
signos y síntomas asociados a estos síndromes.
Bibliografía
1. Rauen KA. The RASopathies. Annu Rev Geno-
mics Hum Genet 2013; 14:355-369.
2. Zenker M. Clinical manifestations of mutations in
RAS and related intracellular signal transduction fac-
tors. Curr Opin Pediatr 2011; 23:443-451.
3. Tartaglia M, Gelb BD, Zenker M. Noonan syn-
drome and clinically related disorders. Best Pract Res
Clin Endocrinol Metab 2011; 25:161-179.
4. Rauen KA, Schoyer L, McCormick F, Lin AE,
Allanson JE, Stevenson DA, et al. Proceedings from the
2009 genetic syndromes of the Ras/MAPK pathway:
from bedside to bench and back. Am J Med Genet A
2010; 152A:4-24.
5.
?im?ek-Kiper PÖ, Alanay Y, Gülhan B, Lissewski
C, Türkyilmaz D, Alehan D, et al. Clinical and molecular
analysis of RASopathies in a group of Turkish patients.
Clin Genet 2013; 83:181-186.
6. Abe Y, Aoki Y, Kuriyama S, Kawame H, Oka-
moto N, Kurosawa K, et al. Prevalence and clinical
features of Costello syndrome and cardio-facio-cuta-
neous syndrome in Japan: findings from a nationwide

52
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
epidemiological survey. Am J Med Genet A 2012;
158A:1083-1094.
7. Digilio MC, Lepri F, Baban A, Dentici ML, Versacci
P, Capolino R, Ferese R, et al. RASopathies: clinical
diagnosis in the first year of life. Mol Syndromol 2010;
1:282-289.
8. Allanson JE, Annerén G, Aoki Y, Armour CM,
Bondeson ML, Cave H, et al. Cardio-facio-cutaneous
syndrome: does genotype predict phenotype?. Am J
Med Genet C Semin Med Genet 2011; 157:129-135.
9. Yoon S, Seger R. The extracellular signal-
regulated kinase: multiple substrates regulate diverse
cellular functions. Growth Factors 2006; 24:21-44.
10. Bos JL. Ras oncogenes in human cancer: a
review. Cancer Res 1989; 49:4682-4689.
11. Aoki Y, Matsubara Y. Ras/MAPK syndromes and
childhood hemato-oncological diseases. Int J Hematol
2013; 97:30-36.
12. Kratz CP, Rapisuwon S, Reed H, Hasle H, Rosen-
berg PS. Cancer in Noonan, Costello, cardio-faciocuta-
neous and LEOPARD syndromes. Am J Med Genet C
Semin Med Genet 2011; 157:83-89.
13. Lee KA, Williams B, Roza K, Ferguson H, David
K, Eddleman K, et al. PTPN11 analysis for the prenatal
diagnosis of Noonan syndrome in fetuses with abnormal
ultrasound findings. Clin Genet 2009;, 75:190-194.
14. Wallace MR, Marchuk DA, Andersen LB, Letcher
R, Odeh HM, Saulino M, et al. Type 1 neurofibroma-
tosis gene: identification of a large transcript disrupted
in three NF1 patients. Science 1990; 249: 181-186.
15. Tartaglia M, Mehler EL, Goldberg R, Zampino G,
Brunner HG, Kremer H, et al. Mutations in PTPN11,
encoding the protein tyrosine phosphatase SHP-2, cause
Noonan syndrome. Nature Genet 2001; 29: 465-468.
16. Jongmans MC, van der Burgt I, Hoogerbrugge
PM, Noordam K, Yntema HG, Nillesen WM, et al.
Cancer risk in patients with Noonan syndrome carrying a
PTPN11 mutation. Eur J Hum Genet 2011; 19:870-874.
17. Romano AA, Allanson JE, Dahlgren J, Gelb BD,
Hall B, Pierpont ME, et al. Noonan syndrome: clinical
features, diagnosis, and management guidelines.
Pediatrics 2010; 126:746-759.
18. Noonan JA, Raaijmakers R, Hall BD. Adult
height in Noonan syndrome. Am J Med Genet A 2003;
123A:68-71.
19. Zenker M, Buheitel G, Rauch R, Koenig R, Bosse
K, Kress W, et al. Genotype-phenotype correlations in
Noonan syndrome. J Pediatr 2004; 144:368-374.
20. Lepri F, De Luca A, Stella L, Rossi C, Baldas-
sarre G, Pantaleoni F, et al. SOS1 mutations in Noonan
syndrome: molecular spectrum, structural insights on
pathogenic effects, and genotype-phenotype correla-
tions. Hum Mutat 2011; 32:760-772.
21. Pandit B, Sarkozy A, Pennacchio LA, Carta
C, Oishi K, Martinelli S, et al. Gain-of-function RAF1
mutations cause Noonan and LEOPARD syndromes
with hypertrophic cardiomyopathy. Nat Genet 2007;
39:1007-1012.
22. Zenker M, Lehmann K, Schulz AL, Barth H,
Hansmann D, Koenig R, et al. Expansion of the geno-
typic and phenotypic spectrum in patients with KRAS
germline mutations. J Med Genet 2007; 44:131-135.
23. Cirstea IC, Kutsche K, Dvorsky R, Gremer L,
Carta C, Horn D, et al. A restricted spectrum of NRAS
mutations causes Noonan syndrome. Nat Genet 2010;
42:27-29.
24. Cordeddu V, Di Schiavi E, Pennacchio LA,
Ma’ayan A, Sarkozy A, Fodale V, et al. Mutation of
SHOC2 promotes aberrant protein N-myristoylation
and causes Noonan-like syndrome with loose anagen
hair. Nat Genet 2009; 41:1022-1026.
25. Niemeyer CM, Kang MW, Shin DH, Furlan I, Erla-
cher M, Bunin NJ, et al. Germline CBL mutations cause
developmental abnormalities and predispose to juvenile
myelomonocytic leukemia. Nat Genet 2010; 42:794-
800.
26. Williams VC, Lucas J, Babcock MA, Gutmann
DH, Korf B, Maria BL. Neurofibromatosis type 1 revi-
sited. Pediatrics 2009; 123:124-133.
27. National Institutes of Health Consensus Develop-
ment Conference Statement 1988. Neurofibromatosis.
Arch Neurol 1988; 45:575-578.
28. Hüffmeier U, Zenker M, Hoyer J, Fahsold R,
Rauch A. A variable combination of features of Noonan
syndrome and neurofibromatosis type I are caused by
mutations in the NF1 gene. Am J Med Genet A 2006;
140:2749-2756.
29. Maertens O, Brems H, Vandesompele J, De
Raedt T, Heyns I, Rosenbaum T, et al. Comprehensive
NF1 screening on cultured Schwann cells from neurofi-
bromas. Hum Mutat 2006; 27:1030-1040.
30. Brems H, Chmara M, Sahbatou M, Denayer E,
Taniguchi K, Kato R, et al. Germline loss-of-function
mutations in SPRED1 cause a neurofibromatosis 1-like
phenotype. Nat Genet 2007; 39:1120-1126.
31. Martínez-Quintana E, Rodríguez-González F.
LEOPARD syndrome: clinical features and gene muta-
tions. Mol Syndromol 2012; 3:145-157.
32. Oishi K, Zhang H, Gault WJ, Wang CJ, Tan
CC, Kim IK, et al. Phosphatase-defective LEOPARD
syndrome mutations in PTPN11 gene have gain-of-
function effects during Drosophila development. Hum
Mol Genet 2009; 18:193-201.
33. Boon LM, Mulliken JB, Vikkula M. RASA1: variable
phenotype with capillary and arteriovenous malforma-
tions. Curr Opin Genet Dev 2005; 15:265-269.

53
Volumen XXI Nº 1 Mayo 2014
A
RROYO
C
ARRERA
I.
ET
AL
- L
AS
RAS
-
PATIAS
34. Yoon G, Rosenberg J, Blaser S, Rauen KA. Neu-
rological complications of cardio-facio-cutaneous syn-
drome. Dev Med Child Neurol 2007; 49):894-899.
35. Siegel DH, McKenzie J, Frieden IJ, Rauen KA.
Dermatological findings in 61 mutation-positive indivi-
duals with cardiofaciocutaneous syndrome. Br J Der-
matol 2011; 164:521-529.
36. Niihori T, Aoki Y, Narumi Y, Neri G, Cavé H, Ver-
loes A, et al. Germline KRAS and BRAF mutations in
cardio-facio-cutaneous syndrome. Nat Genet 2006;
38:294-296.
37. Rodriguez-Viciana P, Tetsu O, Tidyman WE, Estep
AL, Conger BA, Cruz MS, et al. Germline mutations in
genes within the MAPK pathway cause cardio-facio-
cutaneous syndrome. Science 2006; 311:1287-1290.
38. Siegel DH, Mann JA, Krol AL, Rauen KA. Der-
matological phenotype in Costello síndrome: conse-
quences of Ras dysregulation in development. Br J
Dermatol 2011; 164:521-529.
39. Lin AE, Alexander ME, Colan SD, Kerr B, Rauen
KA, Noonan J, et al. Clinical, pathological, and mole-
cular analyses of cardiovascular abnormalities in Cos-
tello syndrome: a Ras/MAPK pathway syndrome. Am J
Med Genet A 2011; 155A:486-507.
40. Gripp KW. Tumor predisposition in Costello syn-
drome. Am J Med Genet C Semin Med Genet 2005;
137C:72-77.
41. Aoki Y, Niihori T, Kawame H, Kurosawa K, Ohashi
H, Tanaka Y, et al. Germline mutations in HRAS proto-
oncogene cause Costello syndrome. Nat Genet 2005;
37:1038-1040.
42. Rauen KA. Cardiofaciocutaneous syndrome. En:
Pagon RA, Bird TC, Dolan CR, Stephens K, editors.
GeneReviews [internet]. Seattle: University of Wash-
ington; 1993-. http://www.ncbi.nlm.nih.gov/books/
NBK1186/
43. Gripp KW, Lin AE. Costello syndrome. En: Pagon
RA, Bird TC, Dolan CR, Stephens K, editors. Gene-
Reviews [internet]. Seattle: University of Washington;
1993-. http://www.ncbi.nlm.nih.gov/books/NBK1507/
44. Li W, Cui Y, Kushner SA, Brown RA, Jentsch JD,
Frankland PW, et al. The HMG-CoA reductase inhibitor
lovastatin reverses the learning and attention deficits in
a mouse model of neurofibromatosis type 1. Curr Biol
2005; 15:1961-1967.
45. Marin TM, Keith K, Davies B, Conner DA, Guha
P, Kalaitzidis D, et al. Rapamycin reverses hypertro-
phic cardiomyopathy in a mouse model of LEOPARD
syndrome-associated PTPN11 mutation. J Clin Invest
2011; 121:1026-1043.
46. Krab LC, de Goede-Bolder A, Aarsen FK, Pluijm
SM, Bouman MJ, van der Geest JN, et al. Effect of
simvastatin on cognitive functioning in children with
neurofibromatosis type 1: a randomized controlled trial.
JAMA 2008; 300:287-294.
47. Acosta MT, Kardel PG, Walsh KS, Rosenbaum
KN, Gioia GA, Packer RJ. Lovastatin as treatment for
neurocognitive deficits in neurofibromatosis type 1:
phase I study. Pediatr Neurol 2011; 45:241-245.
48. Chen PC, Wakimoto H, Conner D, Araki T, Yuan
T, Roberts A, et al. Activation of multiple signaling
pathways causes developmental defects in mice with
a Noonan syndrome–associated Sos1 mutation. J Clin
Invest 2010; 120:4353-4365.
| Adjunto | Tamaño |
|---|---|
| voxpaed21.1pags46-53.pdf | 254.75 KB |



