![]()
Micropene. Revisión
Micropene se define como aquel pene de estructura normal que, sin embargo, tiene una longitud igual o menor a -2’5 desviaciones estándar (DE) de media para su edad y etnia. Esta anormalidad en el tamaño del pene es debida a una alteración del eje hipotálamo- hipofisario-testicular, siendo la etiología idiopática la más frecuente. La exploración física es de suma importancia, ya que hará distinguir el micropene verdadero de aquellas entidades urológicas que presentan un tamaño normal pero que se perciben como penes de menor tamaño. La administración de testosterona exógena proporciona resultados completos en el 90% de los casos y se considera el tratamiento de primera elección, aunque su respuesta es mayor si se administra en los primeros meses de la vida. Se reserva la cirugía reconstructiva para aquellos casos conresultados parciales o en los que no ha sido posible la administración de tratamiento médico. La reasignación a sexo femenino en los casos de micropene aislado constituye una decisión excepcional y en ningún caso justifica su práctica.
Micropenis is defined as a penis of normal structure but whose length is at least 2.5 standard deviations (SD) smaller than the mean for the subject’s age and ethnic group. This abnormal condition is due to a disruption of the hypothalamic-pituitary-testicular axis, whose aetiology is commonly idiopathic. Physical examination is of the utmost importance, enabling true micropenis to be distinguished from those urological disorders in which a normal-sized penis appears smaller. Exogenous testosterone administration fully reverses this condition in 90% of cases, and is therefore the treatment of choice, the best response being obtained when treatment begins in the first months of life. Reconstructive surgery is recommended only when testosterone treatment yields partial results, or when medical treatment is not possible. Gender reassignment is very rarely performed, and is never justified.

31
Volumen XX Nº 2 Octubre 2013
Micropene. Revisión
Priego Ruíz M.P., Cañete Estrada R.
Unidad de Endocrinología Pediátrica. IMIBIC.
Hospital Universitario Reina Sofía. Córdoba
Resumen: Micropene se define como aquel pene de estructura normal que, sin embargo, tiene una lon-
gitud igual o menor a -2’5 desviaciones estándar (DE) de media para su edad y etnia. Esta
anormalidad en el tamaño del pene es debida a una alteración del eje hipotálamo- hipofisario-
testicular, siendo la etiología idiopática la más frecuente. La exploración física es de suma im-
portancia, ya que hará distinguir el micropene verdadero de aquellas entidades urológicas que
presentan un tamaño normal pero que se perciben como penes de menor tamaño. La adminis-
tración de testosterona exógena proporciona resultados completos en el 90% de los casos y
se considera el tratamiento de primera elección, aunque su respuesta es mayor si se administra
en los primeros meses de la vida. Se reserva la cirugía reconstructiva para aquellos casos con
resultados parciales o en los que no ha sido posible la administración de tratamiento médico.
La reasignación a sexo femenino en los casos de micropene aislado constituye una decisión ex-
cepcional y en ningún caso justifica su práctica.
Abstract: Micropenis is defined as a penis of normal structure but whose length is at least 2.5 standard
deviations (SD) smaller than the mean for the subject’s age and ethnic group. This abnormal con-
dition is due to a disruption of the hypothalamic-pituitary-testicular axis, whose aetiology is com-
monly idiopathic. Physical examination is of the utmost importance, enabling true micropenis to
be distinguished from those urological disorders in which a normal-sized penis appears smaller.
Exogenous testosterone administration fully reverses this condition in 90% of cases, and is the-
refore the treatment of choice, the best response being obtained when treatment begins in the
first months of life. Reconstructive surgery is recommended only when testosterone treatment
yields partial results, or when medical treatment is not possible. Gender reassignment is very ra-
rely performed, and is never justified.
Recibido: 10-10-2013 Aceptado: 05-11-2013
Vox Paediatrica 2013; XX(2):31-37
Micropene. Revisión
Según la Real Academia Española (RAE), la palabra
micropene o microfalo está formada por la voz de ori-
gen griego ‘micro’ que significa “pequeño” y por las
palabras ‘pene’ que procede del latín ‘penis’ (“cola”) y
‘falo’ del griego
?????? (“falo, emblema de la genera-
ción”). Aunque en la actualidad falo es utilizado como
sinónimo de pene, el vocablo “phallus” se usaba para
describir imágenes de dicho órgano en pinturas o gra-
bados.
Apuntes históricos
Existe un conjunto de ideas preconcebidas que se
han creado alrededor del pene, sobre su tamaño, lon-
gitud y grosor, que a lo largo de la historia se han ido
desarrollando.
El filósofo griego Heráclito de Éfeso decía allá por el
año 500 a.C. “todo fluye, nada permanece” y haciendo
realidad esta frase, de cultura en cultura, las percepcio-
nes sobre el tamaño del pene han ido cambiando. En
32
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XX Nº 2 Octubre 2013
la Grecia Clásica, lo “deseable” y la “perfección” era un
pene pequeño y no circuncidado, porque lo contrario
era visto como burlesco y fachoso, de ahí que general-
mente aparecieran en “seres mitológicos como los sáti-
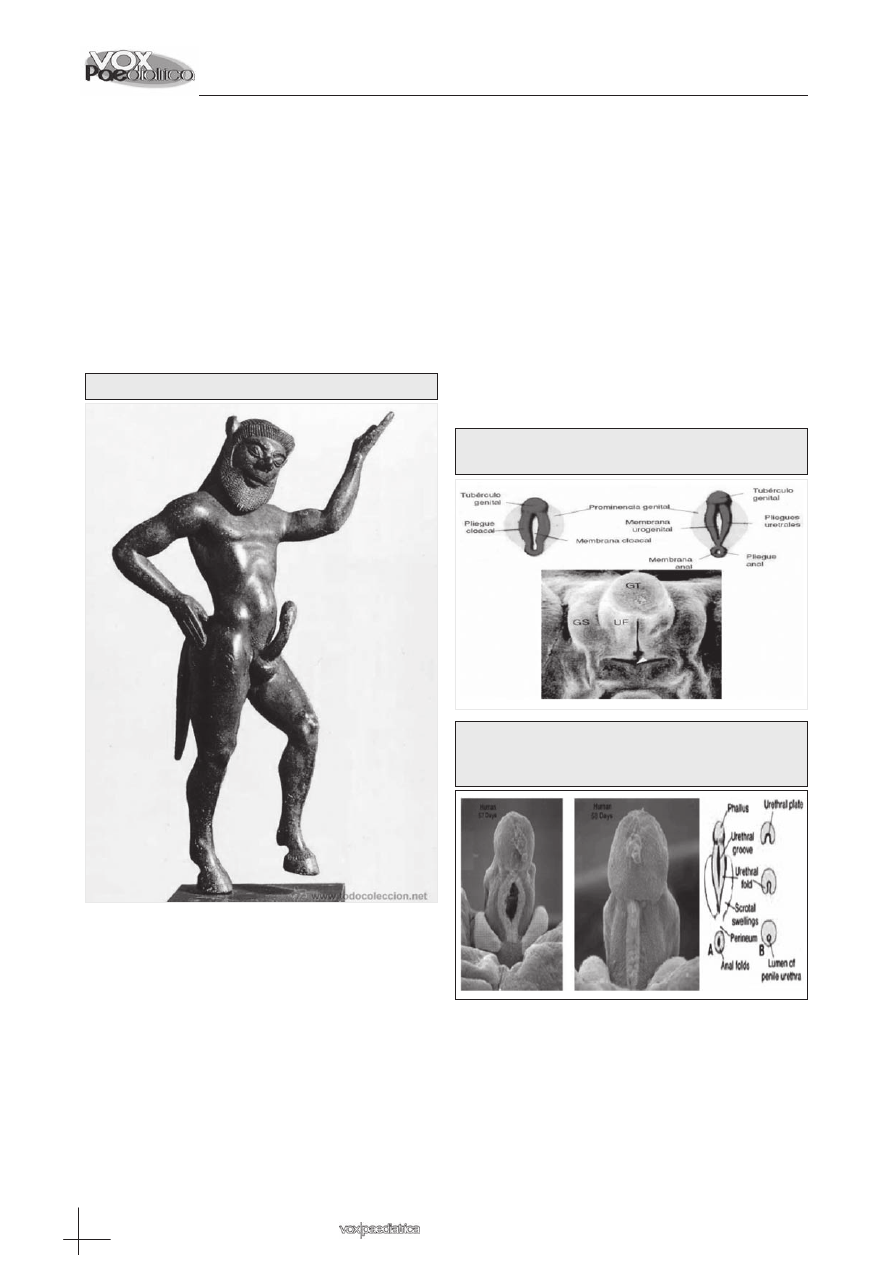
ros” (Figura 1). Por contra, en la Roma Antigua, el he-
cho de tener un pene grande y ancho, gozaba de cierta
consideración y se consideraba admirable.
1
Otras cul-
turas también hacen referencia al tamaño del miem-
bro viril en su literatura; así en Ananga Ranga y Kama
Sutra (manuales sexuales hindúes), existe una clasifi-
cación de los hombres en tres categorías según el ta-
maño de su falo erecto: “liebre”, “toro” y “caballo”.
Figura 1: Estatuilla del Sátiro. Museo de Atenas.
Embriología
El aparato genital está integrado por los órganos ge-
nitales internos y externos. En el desarrollo embrionario
existe una primera etapa indiferenciada (que es igual
en ambos sexos), para después diferenciarse en uno
u otro sexo.
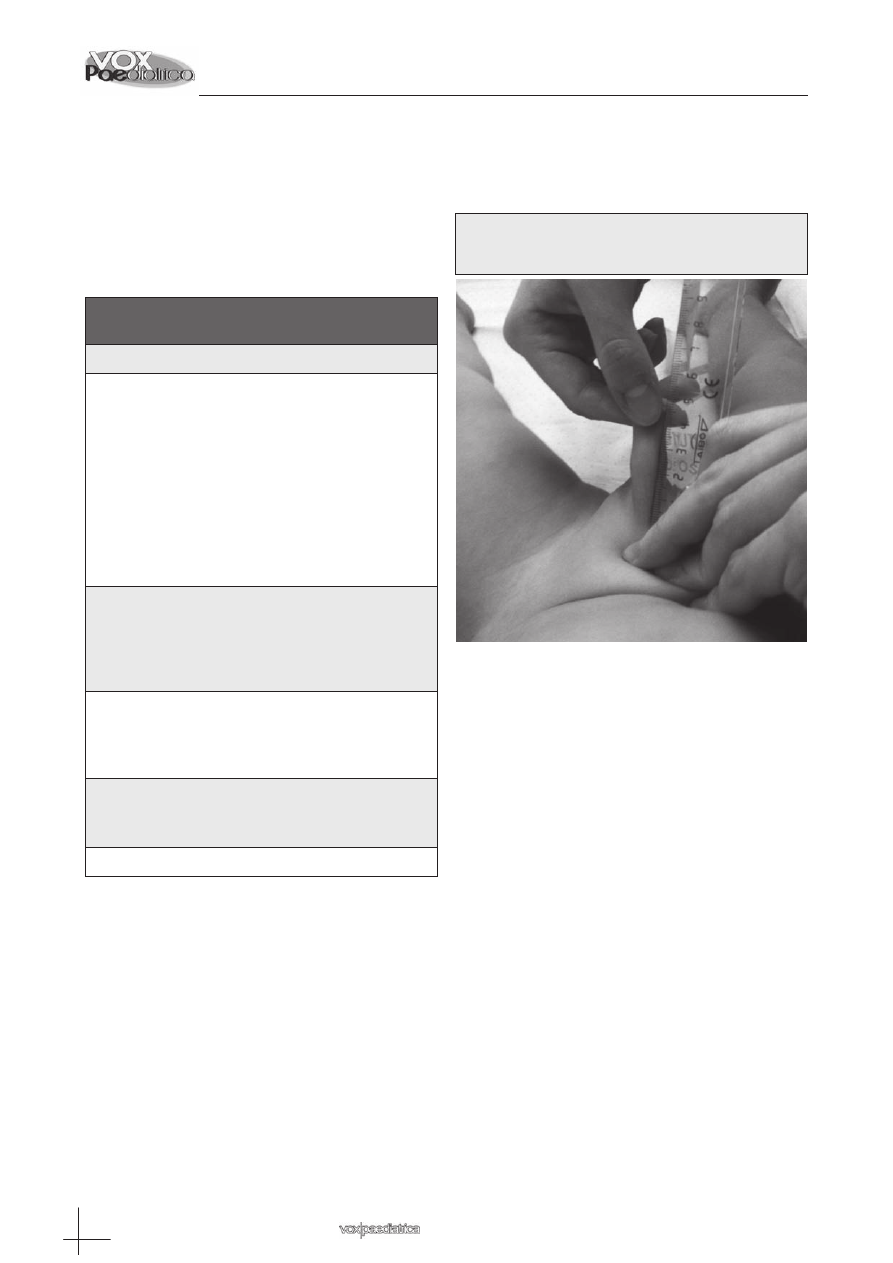
Los genitales externos en ambos son indistinguibles
hasta la séptima u octava semana. Hacia la cuarta se-
mana, la membrana cloacal es abrazada por mesén-
quima de la porción craneal que prolifera, provocando
que sea propulsado el ectodermo adyacente formando
dos protuberancias externas o pliegues cloacales, que
se unen cranealmente formando el tubérculo genital.
Los pliegues cloacales se dividen en anterior o geni-
tal y en posterior o anal.
2,3
(Figura 2) Alrededor de la
novena y décima semana, se puede distinguir a la per-
fección el sexo del nasciturus. La gonadotropina corió-
nica humana (hCG) de la placenta materna comienza
a estimular la producción de testosterona de las célu-
las de Leydig fetales, ésta se transforma en dihidrotes-
tosterona que uniéndose a sus receptores específicos
transforma el tubérculo genital en pene. Durante las se-
manas 16-38, se lleva a cabo el crecimiento gracias
a la acción de los andrógenos fetales, estimulados en
este momento por la gonadotropina pituitaria fetal. El
tubérculo genital se alarga y se transforma en el falo.
Los pliegues genitales se fusionan formando la uretra
membranosa y peneana. En cuanto a las bolsas escro-
tales, se forman al soldarse en la línea media las promi-
nencias genitales.
4,5
(Figura 3)
Figura 2: Etapa indiferenciada del desarrollo
embrionario genital (tomado de Langman, 2007)
Figura 3: Período de diferenciación embrionaria de
los genitales externos masculinos
(tomado de Langman, 2007)
Regulación molecular del desarrollo genital
El gen SRY (del inglés: sex región cromosome Y) lo-
calizado en el brazo corto del cromosoma Y, forma el
factor determinante testicular y regula el desarrollo se-
xual masculino.
5,6
Este gen actúa conjuntamente con el
gen SOX9, estimulando la expresión del gen FIM (factor
inhibidor de Müller) e inhibiendo la del gen WNT4 (gen
determinante de ovario).
7
SRY regula positivamente la producción de SF18
(factor de esteroidogénesis) que junto con SOX9 au-

33
Volumen XX Nº 2 Octubre 2013
M
ICROPENE
. R
EVISIÓN
menta las concentraciones de hormona antimülleriana,
determinando la regresión de los conductos parame-
sonéfricos o de Müller. En las células de Leydig, SF1
estimula la síntesis de testosterona, que o bien queda
intacta o se convierte en dihidrotestosterona por la ac-
ción de la enzima 5-a-reductasa, Estas dos hormonas
se unen a una proteína intracelular, formando el com-
plejo hormona-receptor. Testosterona-receptor pro-
voca la virilización de los conductos mesonéfricos y el
complejo dihidrotestoterona-receptor modula la dife-
renciación de los genitales externos masculinos.
9
Anatomía del pene
Es el órgano masculino que permite la micción y la
cópula. Es semejante a un cilindro y se une a la región
ventral del periné. 10 Su tamaño depende de la edad
del niño, midiendo aproximadamente 3.5-4 centíme-
tros (cm.) en el recién nacido a término, hasta alcanzar
6.3-7-3 cm en la primera década de la vida.
11
El pene propiamente dicho está formado por los
cuerpos cavernosos y por el cuerpo esponjoso, ambos
conforman los llamados órganos eréctiles.
12
El cuerpo esponjoso es recorrido en su interior por la
uretra. La parte distal se expande y forma el glande; el
extremo proximal se prolonga formando el bulbo y se
fija al músculo transverso profundo del periné.
Los cuerpos cavernosos se adosan a la parte pos-
terior del cuerpo esponjoso. En su extremo anterior
encaja con el glande y a medida que se dirigen hacia
la zona proximal, divergen para formar independiente-
mente una raíz que se fija al pubis e isquion.
Su base está sostenida por el ligamento suspensor
que se continúa con la fascia peneana. El pene está re-
cubierto por una serie de envolturas fibroelásticas (muy
semejantes a las del testículo) y por la piel, que está
adherida a toda la longitud excepto en el glande,
10,12
La irrigación superficial depende de las ramas pro-
cedentes de las arterias pudendas externas (ramas a
su vez de la femoral) y de ramas perineales de la arteria
pudenda interna, éstas últimas suministran sangre a los
órganos eréctiles y uretra.
13,14
El nervio genitocrural y el nervio dorsal del pene re-
coge la sensibilidad del pene.
14
Concepto
La definición de micropene hace referencia a un
pene normal en cuanto a su función y estructura (ure-
tra masculina y meato uretral de situación normal) pero
cuya longitud es igual o menor a 2.5 desviaciones es-
tándar (DE) de la media para su edad y desarrollo pu-
beral
15,16
y se describe como microfalo cuando tiene
un longitud como se ha descrito pero se acompaña de
defectos morfológicos. (Tabla I
17
) (Figura 4)
Los trabajos de Shonfeld en la década de los cua-
renta aportaron información de referencia acerca de lon-
gitud y diámetro del pene.
18
Tanner marcó nuevos es-
tándares sobre la longitud peneana en la etapa puberal.
La raza o el país determinan diferencias en la longi-
tud del pene
19
que hacen variar su tamaño estándar,
realizándose en algunos países diferentes estudios con
el fin de estandarizar el tamaño normal del pene en la
infancia y adolescencia.
20-22
Tabla I: Longitud del pene según la edad.
(tomado de Lee et al, 2006)
EDAD
MEDIA +/-
DE
MEDIA -2.5
DE
RN a término
3.5 +/- 0.4
2.4
6 meses
3.9 +/- 0.8
1.9
6-12 meses
4.3 +/- 0.8
2.3
1-2 años
4.7 +/- 0.8
2.6
2-3 años
5.1 +/- 0.9
2.9
3-4 años
5.5 +/- 0.9
3.3
4-5 años
5.7 +/- 0.9
3.5
5-6 años
6.0 +/- 0.9
3.8
6-7 años
6.1 +/- 0.9
3.9
7-8 años
6.2 +/- 0.9
3.7
8-9 años
6.3 +/- 1.0
3.8
9-10 años
6.3 +/- 1.0
3.8
10-11 años
6.4 +/- 1.1
3.7
Adulto
13.3 +/- 1.6
9.3
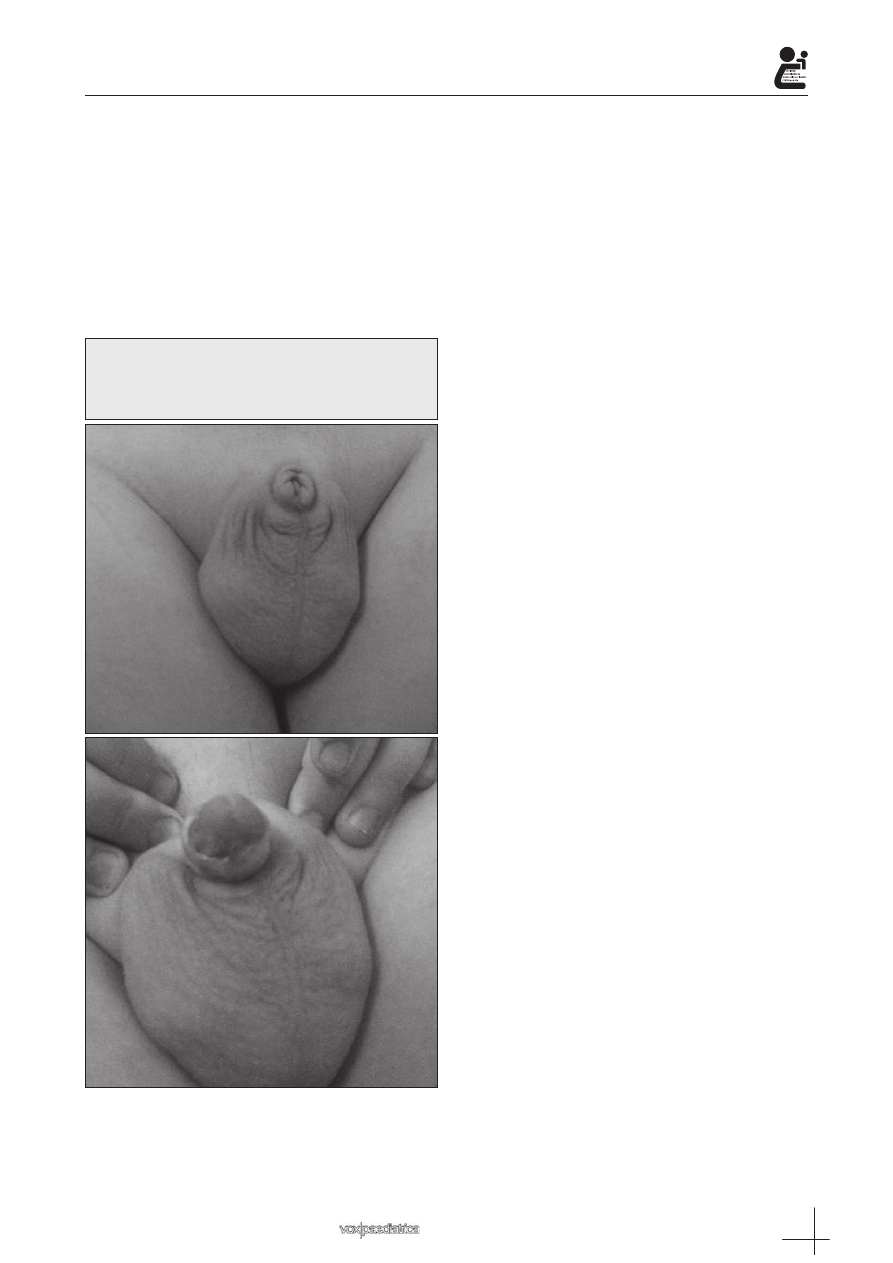
Imagen 4: Micropene aislado en lactante de
2 meses
34
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XX Nº 2 Octubre 2013
Etiología
La presencia de micropene verdadero en el recién
nacido se debe a una anormalidad hormonal produ-
cida a partir de la 12 semana de gestación. Esta altera-
ción se produce por una serie de causas
23-25
y las más
frecuentes se exponen en la tabla (Tabla II
26
), siendo
la idiopática la más prevalente, estimándose alrededor
del 50% los casos de micropene debidos a ésta.
27
Tabla II: Etiología del micropene
(tomado de Wiygul et al 2011)
1. IDIOPÁTICO
2. HIPOGONADISMO HIPOGONADOTROPO
– Síndrome de Kallmann
– Síndrome de Prader-Willi
– Síndrome de Laurence-Moon
– Síndrome de Rud
– Síndrome de Noonan
– Síndrome de Down
– Síndromes polisómicos ligados al cromosoma X
– Aplasia congénita de la glándula pituitaria
– Agenesia del cuerpo calloso 26
– Disgenesia gonadal
3. HIPOGONADISMO HIPERGONADOTROPO
– Anomalías del receptor LH
– Déficit de GH/IGF-I
– Síndrome de insensibilidad parcial a andrógenos
– Déficit 5-a reductasa
4. YATRÓGENO
– Síndrome fetal por exposición a hidantoína
– Administración de progesterona durante emba-
razo
5. MALFORMACIONES GENITALES
– Afalia
– Extrofia cloacal
6. ASOCIADO A SÍNDROMES POLIMALFORMATIVOS
Diagnóstico
La medida del pene se obtiene elongando éste con
sumo cuidado y midiendo el falo desde la sínfisis pu-
biana o base del pene (deprimiendo la grasa púbica)
hasta la punta del glande. Esta medición debe reali-
zarse por la cara dorsal y preferiblemente con una regla
rígida.
11
(Figura 5)
Se debe comprobar que el resto de exploración ge-
nital sea normal, así como cerciorarse que los testes se
encuentran en las bolsas escrotales
28
.
Una vez confirmada la existencia de micropene me-
diante el examen físico, se debe iniciar un estudio endo-
crinológico completo del eje hipotálamo-hipófisis-gona-
dal
29
(es fundamental destacar la importancia de reali-
zar el diagnóstico etiológico de micropene en los prime-
ros seis meses de vida, porque en este período existe
una estimulación transitoria de este eje, período llamado
“minipubertad” de la pequeña infancia, y que no vol-
verá a reiniciarse hasta el comienzo de la pubertad).
30
Imagen 5: El pene se mide desde el pubis hasta la
punta del glande, elongando el falo y midiéndose con
regla rígida por la cara dorsal.
El estudio hormonal incluye determinaciones de LH
y FSH en situación basal y tras estimulación hormo-
nal [prueba de factor liberador de la hormona luteini-
zante (LHRH por sus siglas en inglés), para buscar un
déficit gonadotrópico], estimaciones de testosterona y
dihidrotestosterona antes y después de estimulación
con HCG, ésta última valora la producción de testos-
terona.
11, 26
La presencia de micropene puede ser la única clave
que haga sospechar la posible presencia de un panhi-
popituitarismo, por lo que en el estudio inicial se deben
también incluir niveles de glucemia, GH, adrenocor-
ticotropina (ACTH), cortisol, factor de crecimiento in-
sulínico (IGF-I), IGFBP-3 (del inglés: Insulin-like growth
factor binding protein-3), tirotropina (TSH) y prolactina
(PRL).
27, 31,32
La hormona antimülleriana (AMH) y la Inhibina B se
podrían determinar en caso de micropene aislado, ya
que demostrarían la presencia de tejido testicular fun-
cionante
26
.
Se recomienda efectuar cariotipo en todos los casos
y de confirmarse existencia de panhipopituitarismo, se
deberá realizar resonancia magnética cerebral para va-
lorar la integridad anatómica de las estructuras hipotá-
lamo-hipofisarias
26,27
Diagnóstico diferencial
Al hablar de micropene, se debe distinguir aquellas
entidades urológicas que presentan penes de tamaño
35
Volumen XX Nº 2 Octubre 2013
M
ICROPENE
. R
EVISIÓN
normal pero que sin embargo, parecen ser de menor
tamaño.
33,34
El pene enterrado u oculto se encuentra
escondido en la grasa suprapúbica, siendo frecuente
su hallazgo en niños obesos o secundarios a fimosis
importante (Figura 6). El pene caído, se debe a alte-
ración del ligamento suspensorio. Otra entidad que
forma parte de este grupo de pseudomicropene es el
pene palmeado, en donde la piel escrotal se extiende
hasta la cara ventral del pene lo que hace que se fije al
escroto.
Imagen 6: Pene enterrado u oculto en niño de diez
años con sobrepeso. Se aprecia cómo al deprimir el
niño la grasa suprapúbica el pene es normal, aun-
que circuncidado.
Tratamiento
La administración de testosterona exógena cons-
tituye la primera opción terapéutica del micropene. La
mayoría de los autores son partidarios de utilizar 25 mg
de testosterona vía intramuscular (de elección) cada
3 semanas durante tres-cuatro meses, fundamental-
mente en forma de dos análogos sintéticos: ciclopentil-
propionato o cipionato y enantato, cuya acción prolon-
gada producen efectos androgénicos durante 21 días.
35
La aplicación de testosterona por vía tópica no cons-
tituye una buena vía de elección, debido a su irregular
absorción.
36
Se recomienda iniciar tratamiento durante los prime-
ros meses de vida, porque en esta etapa existe ma-
yor dotación y afinidad de receptores androgénicos,
seguidos de dosis mayores al comienzo de la puber-
tad. El uso de terapia combinada con andrógenos y
gonadotropinas en el período neonatal ha demostrado
mayor eficacia, porque hay una proliferación de células
de Sertoli y un crecimiento de túbulos seminíferos, au-
mentando el volumen testicular y la espermatogénesis
en edad adulta.
30, 37
El uso de testosterona durante periodos cortos de
tiempo no determina riesgo significativo alguno en
cuanto a la maduración temprana de las placas de cre-
cimiento óseas, lo que tendría consecuencias adversas
sobre la talla
30, 38
. Se puede observar además con este
tratamiento desarro llo de vello púbico, hiperpigmenta-
ción del escroto y ginecomastia.
Este tratamiento es efectivo en 90 por ciento de los
casos y en situaciones con mala respuesta hay descar-
tar un déficit de 5-
?-reductasa o un síndrome menor de
insensibilidad a los andróngenos.
39
Si el tratamiento endocrinológico no logra un re-
sultado satisfactorio, el tratamiento quirúrgico puede
ofrecer una alternativa, siendo necesaria la realización
de técnicas reconstructivas una vez llegada la edad
adulta.
40
En la década de los 70, Hinman comenzó a utilizar la
cirugía reconstructiva como opción al tratamiento mé-
dico.
41
A lo largo de los años las técnicas han ido avan-
zando, siendo aceptables tanto los resultados estéti-
cos como los funcionales, no obstante no se debe ob-
viar las complicaciones que suponen un desafío incluso
para las más experimentadas manos.
42, 43
La reasignación de sexo debe hacerse con extrema
precaución debido a la falta de datos sobre el impacto
psicológico que supone a largo plazo en los pacientes
pediátricos. Si bien algunos datos parecen promover
la idea de que la mayoría de los pacientes reasigna-
dos se sienten cómodos con el sexo asignado, inde-
pendientemente del cromosómico.
44
Otros autores han
encontrado problemas psicosexuales significativos en
pacientes adultos que se sometieron a cambio de sexo
en la infancia.
45
Bibliografía
1. Adams C. “Why does so much ancient Greek art
feature males with small genitalia?” The Straight Dope.
December 09 2005.

36
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XX Nº 2 Octubre 2013
2. Escolar. Anatomía humana funcional y aplicativa.
4a ed. Barcelona: Espaxs; 2003: pp 130-47.
3. Rey R, Copelli SB. Diferenciación sexual embrio-
fetal. En: Pombo M. Tratado de Endocrinología Pediá-
trica. 4a ed. Madrid: McGraw-Hill, Interamericana
2009: 125-37.
4. Larsen WJ. Desarrollo del sistema urogenital. En:
Embriología Humana.3a ed. Madrid: Elsevier; 2003:
265-315.
5. Langman S. Embriología Médica con orientación
clínica. 10a ed. Buenos Aires: Panamericana; 2007
6. Berta P, Hawkins JR, Sinclair AH, Taylor A,
Griffiths BL, Goodfellow PN, Fellous M.. Genetic evi-
dencie equating SRY and the testis determining factor.
Nature 1990; 29;348: 448-50
7. Jameson SA, Lin YT, Capel B.Testis development
requires the repression of Wnt4 by Fgf signaling. Dev
Biol. 2012; 370: 24-32.
8. El-Khairi R, Achermann JC. Steroidogenic
factor-1 and human disease. Semin Reprod Med.
2012; 30: 374-81.
9. Cañete R, Jiménez L. Ontogenia y diferenciación
gonadal. En: Diéguez, C. Yturriaga, R. Actualizaciones
en Endocrinología. Madrid, McGraw-Hill-Interameri-
cana de España; 2001: 1-19
10. Vozmediana Chicharro R, Bonilla Parrilla R.
Recuerdo y actualización de las bases anatómicas del
pene. Arch Esp Urol. 2010; 63; 575-80.
11. Martínez- Aedo MJ. Micropene. En: López
Siguero JP, Garcia Cuartero B. Endocrinología Pediá-
trica: Manual práctico. Madrid: Médico Panamericana
2013; 11:131-35
12. .Platas Sancho, A. Anatomía funcional del pene.
En: Sáez de Tejada I. Allona A. F Erección, eyaculación
y sus trastornos. Madrid; 1997. pp 1-12.
13. Moore KL, Dalley AF. Anatomía con orientación
clínica. 5ª ed. México, Panamericana; 2007.
14. Escolar. Anatomía humana funcional y aplica-
tiva. Volumen II. 4ª ed. Barcelona: Espaxs. Barcelona;
2003: pp 1080-92.
15. Cañete R, Suanes A. Micropene.. En: Ferrández
Longás A, Pombo Arias M, Rodríguez Hierro F, Yturriaga
Matarranz R, Algoritmos diagnósticos-terapéuticos en
Endocrinología Pediátrica Madrid, Semfar 1998: 379-
400
16. Lee JH, Ji YH, Lee SK, Hwang HH, Ryu DS, Kim
KS, Choo HS, Park S, Moon KH, Cheon SH, Park S.
Change in penile length in children: preliminary study.
Korean J Urol 2012; 53: 870-4.
17. Lee PA, Houk CP, Ahmed SF, Hughes IA. Inter-
national Consensus Conference on Intersex organized
by Lawson Wilkins Pediatric Endocrine Society and the
European Society for Paediatric Endocrinology. Con-
sensus statement on management of intersex disor-
ders. International Consensus Conference on Intersex.
Pediatrics 2006; 118: 814-5
18. Schonfeld WA, Beebe GW. Normal growth and
variation in the male genitalia from birth from maturity. J
Urol 1942; 48: 759-77
19. PK, Chanoine JP. Should the definition of micro-
penis vary according to ethnicity? Horm Res 2001; 55:
278-81
20. Wang CH, Lin WD, Bau DT, Tsai CH, Liu DC, Tsai
FJ. Penile length of normal boys in Taiwan. Acta Pae-
diatr 2006; 47:pp 293-6.
21. Gabrich, PN, SP Juliana, Vasconcelos RD, da
Silva EA Penile anthropometry in Brazilian children and
adolescents. J Pediatr 2007;83: 441-6
22. Cinaz P, Yesilkaya E, Onganlar YH, Boyraz M,
Bideci A, Camurdan O, et al. Penile anthropometry
of normal prepubertal boys in Turkey. Acta Pae-
diatr. 2012;101: 33-6
23. Lee, PA, Mazur, T, Danish, R, Amrhein, J, Bliz-
zard RM, Money J, Migueon, CJ. Micropenis. Criteria,
etiologies and classification. Johs Hopkins Med J 1980;
146: 156-63.
24. Ikbal M, Tastekin A, Ors R. Micropenis in a
newborn with acrocallosal syndrome. Genet Couns
2004;15: 233-5
25. Zdravkovi
? D, Milenkovi? T, Sedlecki K, Gu?-
S
?eki? M, Raji? V, Bani?evi? M. Causes of ambiguous
external genitalia in neonates.Srp Arh Celok Lek.
2001;129: 57-6
26. Wiygul J, Palmer LS. Micropenis. The Scientific
World Journal. 2011; 11: 1462-9
27. Paris F, De Ferran K, Bhangoo A, Ten S, Lahlou
N, Audran F, Servant N, Poulat F, Philibert P, Sultan
C. Isolated ‘idiopathic’ micropenis: hidden genetic
defects? Int J Androl. 2011; 345: 18-25
28. Tekgül S, Riedmiller H, Gerharz E, Hoebeke P,
Kocvara R, Nijman R, Radmayr C, Stein R. Guía clínica
sobre urología pediátrica. European Society for Pae-
diatric Urology. European Association of Urology. 2010:
26-7
29. Ludwig, G. Micropenis and apparent micropenis-
a diagnostic and therapeutic challenge. 1999;31 Suppl
1:27-30
30. Grumbach MM. A window of opportunity:
the diagnosis of gonadotropin deficiency in the male
infant. J Clin Endocrinol Metab. 2005; 90: 3122-7.
31. Atreja G, Bustani P, Indian J. Congenital hypopi-
tuitarism and renal failure. Endocrinol Metab 2011;15:
253-4
32. Massa GG, Langenhorst V, Oostdijk W, Wit JM.
Micropenis in children: etiology, diagnosis and therapy.
Ned Tijdschr Geneeskd .1997; 141: 511-5

37
Volumen XX Nº 2 Octubre 2013
M
ICROPENE
. R
EVISIÓN
33. Bergeson PS, Hopkin J, Bailey RB, McGill LC,
Piatt JP. Incospicuous penis. Pediatrics, 1993; 11:
794-9.
34. Srinivasan AK, Palmer LS, Palmer JS. Inconspi-
cuous Penis. The Scientific World Journal 2011; 11:
2559-64
35. Zenaty D, Dijoud F, Morel Y, Cabrol S, Mouri-
quand P, Nicolino M, Bouvatier C, Pinto G, Lecointre
C, Pienkowski C, Soskin S, Bost M, Bertrand AM, El-
Ghoneimi A, Nihoul-Fekete C, Léger J. Bilateral anor-
chia in infancy: occurence of micropenis and the effect
of testosterone treatment. J Pediatr 2006;149: 687-91.
36. Vanelli M, Bernasconi S, Terzi C, Bolondi O,
Boselli E, Virdis R, Gionvannelli G. Micropenis. Results
of treatment with testosterone. Arch Fr Pediatr 1984;
41: 473-6.
37. Bouvattier C, Maione L, Bouligand J, Dodé C,
Guiochon-Mantel A, Young J. Neonatal gonadotropin
therapy in male congenital hypogonadotropic hypogo-
nadism. Nat Rev Endocrinol 2011; 8: 172-82.
38. Bin-Abbas B, Conte FA, Grumbach MM, Kaplan
SL. Congenital hypogonadotropic hypogonadism and
micropenis: effect of testosterone treatment on adult
penile size. Why sex reversal is not indicated. J Pediatr
1999; 134: 579-83
39. Ishii T. The child with small penis. 9th Joint Mee-
ting of Paediatrica Endocrinology. ESPE-PES-APEG-
ASPAE-JSPE-SLEP. September 19-22 2013 Milan,
Italy. Meet the Expert Handouts
40. Prieto Veiga J, Prieto Matos P. Micropene. En:
Pombo M. Tratado de Endocrinología Pediátrica. 3a ed.
Madrid: McGraw-Hill, Interamericana; 2002: 804-11
41. Hinman FJ.Microphallus: characteristics and
choice of treatment from a stydy of 20 cases. J.Urol
1972; 107: 499-505.
42. Salgado CJ, Chim H, Tang JC, Monstrey SJ,
Mardini S. Penile reconstruction. Semin Plast Surg
2011; 25: 221-8.
43. Kayes O, Shabbir M, Ralph D, Minhas S. Thera-
peutic strategies for patients with micropenis or penile
dysmorphic disorder. Nat Rev Urol 2012; 9: 499-50
44. Wisniewski AB, Migeon CJ, Gearhart JP, Rock
JA, Berkovitz GD, Plotnick LP, Meyer-Bahlburg HF, and
Money J. Congenital micropenis: long-term medical,
surgical and psychosexual follow-up of individuals
raised male or female. Horm Res 2001; 56: 3-11
45. Reiner WG, Kropp BP. A 7-year experience of
genetic males with severe phallic inadequacy assigned
female. J Urol 2004; 172: 2395-8
| Adjunto | Tamaño |
|---|---|
| voxpaed2.2pags32-38.pdf | 255.98 KB |



