![]()
Infecciones respiratorias graves en pacientes inmunodeprimidos de causa oncohematológica.
Introducción: Las infecciones respiratorias graves en pacientes oncohematológicos suponen una causa importante de morbimortalidad. El objetivo es conocer la casuística de nuestra unidad.
Material y métodos: Revisión retrospectiva de casos ocurridos entre 2008-2011 en el Hospital Virgen del Rocío.
Resultados: Se analizaron 27 episodios. La clínica más frecuente fue la tos (81.5%). Presentaron hipoxemia el 96% y hasta el 44% precisó algún tipo de soporte ventilatorio. Dentro delestudio microbiológico, en el 37% se encontró un agente causal; siendo los virus los agentes más frecuentes: 30% virus respiratorio sincitial, 20% gripe A, 20% citomegalovirus. La mortali-dad fue del 18.5%.
Conclusión: Los virus son los agentes causales más aislados, aunque en la mayoría de los casos no consigue identificarse el agente causal.
Background: Severe respiratory tract infection has a serious impact on morbidity and mortality in immunocompromised cancer patients. The aim of the study is to obtain information about this pathology in our unit.
Methods: Retrospective review of cases between years 2008-2011 in a tertiary level centre in Seville.
Results: We analyzed 27 cases. The clinical finding more frequently found was cough (81.5%). Until 96% of patients had hypoxemia and 44% needed any kind of ventilatory support.
We found a causative agent in 37% of the total cases, where viral agents were the most commonly isolated: respiratory syncitial virus 30%, influenza A virus 20% and cytomegalovirus 20%. Our mortality rate was 18.5%.
Conclusions: Viral agents are the most frequently isolated, although in the majority of cases we are not able to identify a causative agent.

23
Volumen XXI Nº 1 Mayo 2014
D
ÍAZ
F
LORES
M.I.
ET
AL
- I
NFECCIONES
RESPIRATORIAS
GRAVES
EN
PACIENTES
INMUNODEPRIMIDOS
DE
CAUSA
ONCOHEMATOLÓGICA
Introducción
El uso de terapias altamente citotóxicas con gran
poder mieloablativo así como la mejora en las técnicas
quirúrgicas y radioterápicas han conseguido aumen-
tar la supervivencia del cáncer en la infancia, con cifras
que se establecen en torno al 80% a los 5 años. Sin
embargo estas terapias han incrementado el riesgo de
adquirir diferentes tipos de infecciones
[1]
.
Las infecciones respiratorias tienen una incidencia no
bien conocida, oscilando entre 0,5-34%, si bien las po-
blaciones de estudio y definiciones son heterogéneas
[2-4]
.
La clínica fundamentalmente es respiratoria, aunque
en ocasiones pueden presentar síntomas característi-
cos de algún germen
[5]
.
La etiología es variable y depende fundamental-
mente del tipo de inmunidad más afectado, así como
el grado y tiempo de inmunosupresión. Las bacterias
parecen ser las más frecuentes en el curso temprano y
los hongos en estadios más avanzados. Los virus es-
tán demostrando un papel importante como agentes
causales
[5-9]
.
El tratamiento tiene dos vertientes, una de ellas ba-
sada en las medidas de soporte y otra que incluye el
tratamiento etiológico. Éste último debe cubrir los gér-
menes más habituales según la sospecha y el estado
clínico del paciente; y ser modificado en función de la
evolución y las pruebas complementarias
[10,11]
.
En nuestro centro, existe un protocolo clínico sobre
el manejo de pacientes oncohematológicos con neu-
mopatía creado por un grupo de trabajo formado por
hematólogos, oncólogos, intensivistas, neumólogos,
cirujanos y radiólogos pediátricos; así como microbió-
logos, anatomopatólogos y preventivistas. La intención
era establecer unas directrices para el manejo de estos
pacientes desde el punto de vista de las pruebas diag-
nósticas, tratamiento de soporte y antibiótico basado
en las últimas evidencias científicas. El tratamiento varía
según la clínica, el tipo de paciente y el tipo de infiltra-
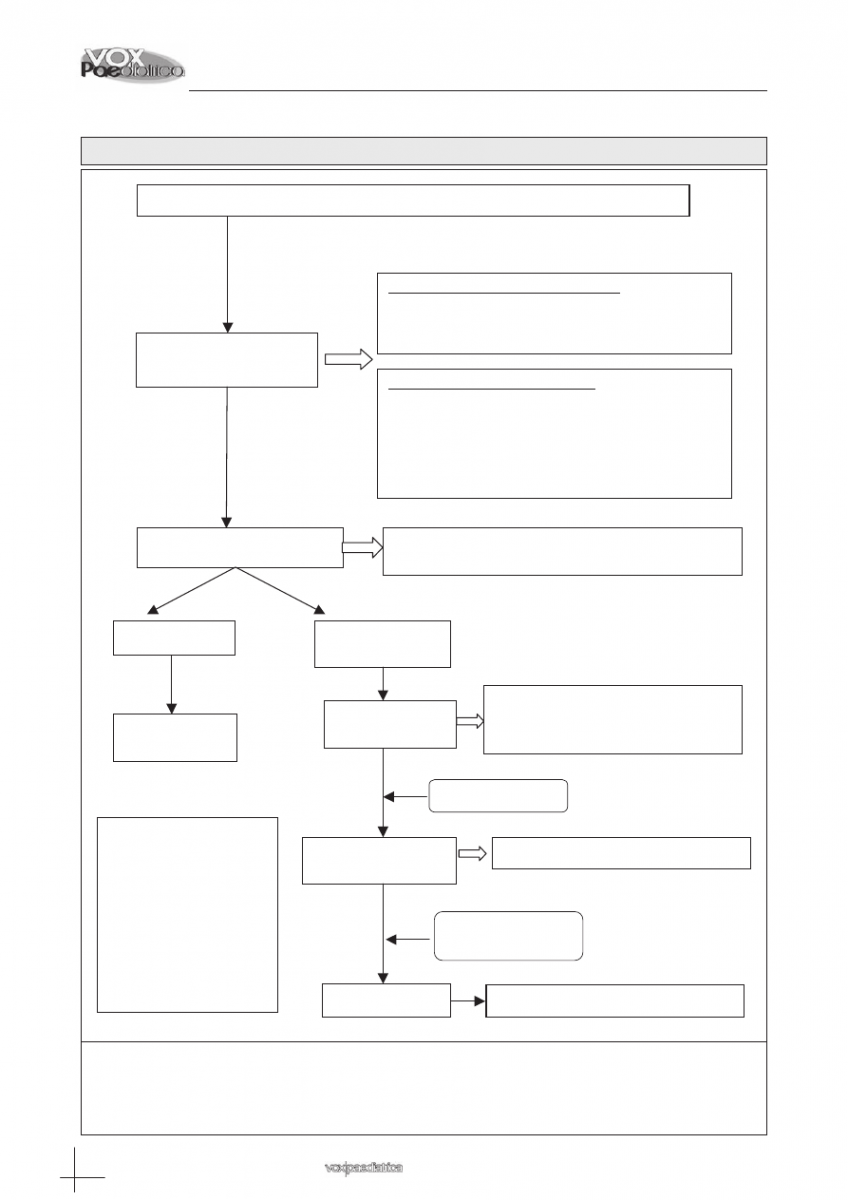
dos. El resumen se detalla en la figura 1.
Nuestro estudio pretende conocer la incidencia,
etiología, características clínicas y pronóstico de estas
infecciones en nuestro medio.
Material y Métodos
Se revisaron retrospectivamente 30 episodios de
27 pacientes de oncohematología pediátrica desde ju-
nio-2008 hasta julio-2011. Los datos fueron recogidos
en una base de datos e incluía múltiples variables de
interés.
Se incluyeron pacientes con:
– Fiebre (temperatura axilar > 38,5ºC puntual o >38ºC
mantenida > de 1 hora) asociada a dificultad respi-
ratoria.
– Neoplasias oncohematológicas en tratamiento de su
enfermedad.
– Enfermedades hematológicas no malignas que
hayan recibido trasplante de progenitores hemato-
poyéticos.
Se excluyeron 3 pacientes: 1 paciente en remisión
completa de leucemia que ya había finalizado el trata-
miento de su enfermedad, 1 paciente por inmunode-
presión primaria previo a la realización del trasplante, 1
paciente con fiebre, síntomas catarrales sin dificultad o
insuficiencia respiratoria.
El estudio fue aprobado por nuestro comité ético y
cumple con la normativa legal vigente.
Resultados
Se registraron 27 casos de 23 pacientes cuyas ca-
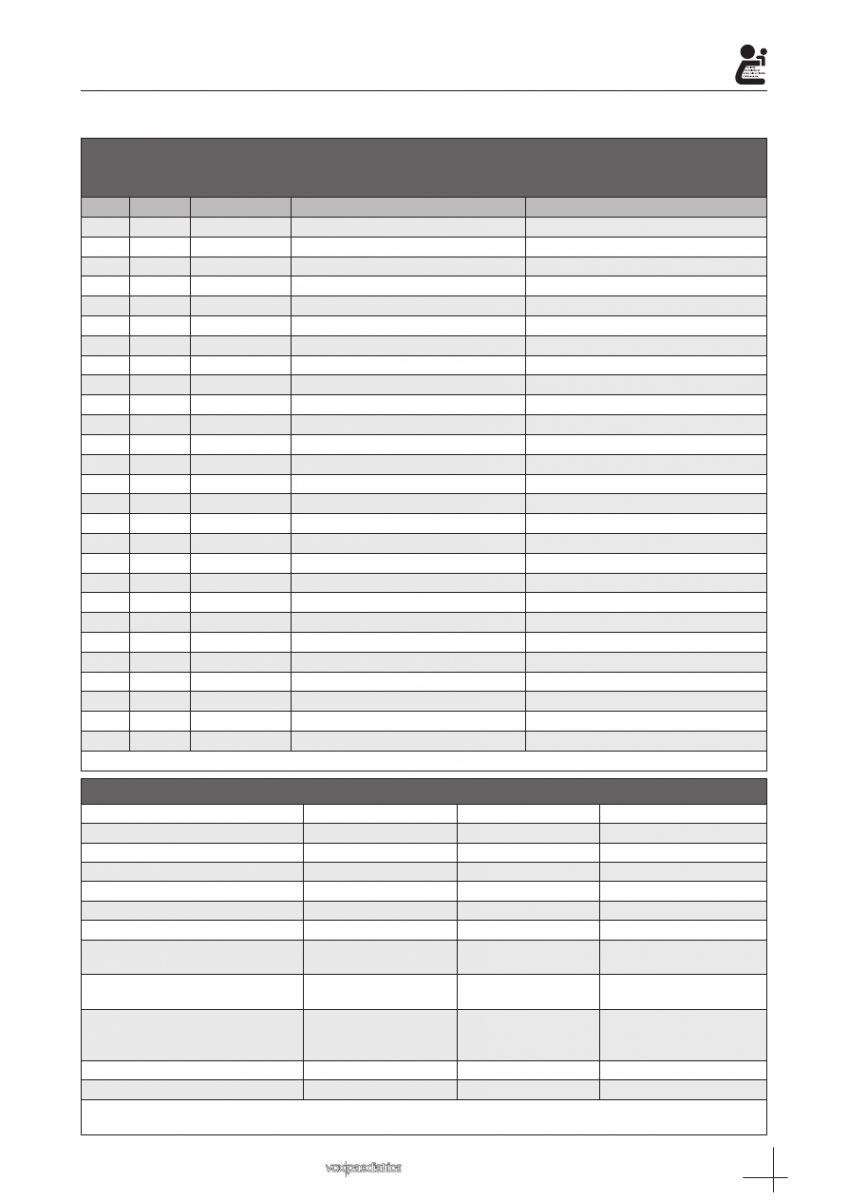
racterísticas demográficas se encuentran en la tabla I.
La incidencia fue del 0.06 % para el periodo descrito.
Se recogió la actividad del tumor en el momento del
episodio. En los pacientes de Oncología se encontró
que la mayoría de los pacientes se encontraban en
periodo de remisión completa (6/16 = 37,5%). En fre-
cuencia, le siguieron los pacientes con progresión de la
enfermedad con un 25% (N=4), con recidiva el 12,5%
(N=2), y con remisión completa el 6,25% (N=1). Ningún
paciente se encontraba con enfermedad estable y en
3 pacientes no se evaluó el estado de la enfermedad.
En los pacientes afectos de hemopatías malignas, se
dividieron según el estadío y tratamiento: inducción a la
remisión, consolidación, mantenimiento, reinducción y
postrasplante. De los 7 casos estudiados, 3 (42%) se
encontraban en remisión completa (2 recibiendo tra-
tamiento de consolidación y 1 de mantenimiento), 2
(28,5%) en el tratamiento de inducción a la remisión,
otro en el tratamiento de reinducción por recaída. Un
último paciente se encontraba en fase pretrasplante de
una leucemia mielomonocítica crónica.
En los 4 restantes casos, se trata de pacientes so-
metidos a TPH por patología no maligna.
La clínica de presentación más frecuente fue la tos
(81.5%), seguida de dolor torácico (25,9%) y abdomi-
nal (18,5%); cianosis (25,9%) y hemoptisis (7,4%). La
hipoxemia apareció en 96% de los pacientes y el 40,7%
desarrolló síndrome de distrés respiratorio agudo.
En nuestra serie, el 57,6% de los casos presentaron
neutropenia < 500 células/mm3 con una duración me-
dia de 8,46 días.
Evaluando las técnicas de imagen, se realizó ra-
diografía de tórax (Rx) en todos los pacientes; en el
85.2% se encontraron imágenes patológicas. Se llevó
a cabo TAC torácico en el 63%, todos con hallazgos
patológicos. De los cuatro pacientes con Rx normales,
se realizó TAC sólo en tres, presentando los tres casos
alteraciones. La concordancia entre los hallazgos Rx y
TAC fue del 66,6%.
Se extrajeron hemocultivos en el 100% de los pa-
cientes, siendo positivos 25,9%. Aislándose S. epider-
24
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
Tratamiento
antimicrobiano empírico
Infiltrados pulmonares difusos
b
:
Hematológicos: Cefepime +
Azitromicina+Anfotericina B liposomal + TMP-SMX
Oncológicos: Ceftazidima o Cefepime + Azitromicina
+ TMP-SMX
Añadir al TMP-SMX metilprednisolona IV
Infiltrados pulmonares localizados
a
:
Hematológicos: Cefepime + Azitromicina
Anfotericina B liposomal
Oncológicos: Ceftazidima o Cefepime + Azitromicina
Realizar la toma de muestras para diagnóstico microbiológico
Valoración clínica continuada
Mejoría clínica
No mejoría clínica
en 48-72 horas
Continuar igual
tratamiento
Realizar TAC alta
resolución
En caso de sepsis o shock séptico
c
, cambiar
Ceftazidima /Cefepime por Vancomicina + Meropenem
Tratamiento empírico según hallazgos
Si imágenes de aspergillosis, añadir
Anfotericina o Voriconazol
Fibrobroncoscopia
con BAL
No mejoría 48-72h
No mejoría 48-72h.
No diagnóstico
Biopsia pulmonar
Tratamiento empírico según hallazgos
Tratamiento empírico según hallazgos
Mantener ATB empírico 7-
10 días.
Suspender Azitromicina
en 72h sin Legionella neg.
Suspender Vancomicina
si hemocultivo negativo
para MARSA.
Suspender TMP-SMX y
CEI si FBC negativa para
pneumocystis.
Figura 1: Esquema sobre el manejo terapéutico de los pacientes.
a
En los infiltrados localizados, la etiología más probable son las bacterias pero en pacientes hematológicos,
siempre se deben cubrir hongos.
b
En los infiltrados difusos, hemos de tener presente además la posibilidad de pneumocystis como causante del cuadro.
c
Cuando el paciente presenta clínica de sepsis, debe ampliarse el espectro antibiótico para una mayor cobertura.
TMP-SMX: trimetropín-sulfametoxazol.
25
Volumen XXI Nº 1 Mayo 2014
D
ÍAZ
F
LORES
M.I.
ET
AL
- I
NFECCIONES
RESPIRATORIAS
GRAVES
EN
PACIENTES
INMUNODEPRIMIDOS
DE
CAUSA
ONCOHEMATOLÓGICA
Tabla I: Características de los pacientes: en la siguiente gráfica se detalla el sexo, la edad,
la enfermedad de base de los pacientes, así como el estadío de la enfermedad.
Los subíndices
“x”, “z”, “n”
, hacen referencia a varios episodios sufridos por el mismo paciente.
Caso
Sexo
Edad (meses)
Enfermedad de base
Actividad del tumor
1x
Mujer
35
TPH Síndrome de Hurler
-
2x
Mujer
39
TPH Síndrome de Hurler
-
3x
Mujer
48
TPH Síndrome de Hurler
-
4
Mujer
66
TPH Síndrome Mielodisplásico
-
5
Hombre
94
L. linfoblástica T
Remisión completa. Consolidación
6
Hombre
67
L. linfoblástica T
Inducción a la remisión
7z
Mujer
34
L. linfoblástica T
Remisión completa. Consolidación
8z
Mujer
56
L. linfoblástica T
Remisión completa. Mantenimiento.
9
Mujer
118
L. mieloblástica
Inducción a la remisión
10
Mujer
147
L. linfoblástica B
Recaída. Reinducción
11
Hombre
30
L. mielomonocítica
Pretrasplante.
12
Hombre
192
Linfoma B. S. Duncan.
Remisión completa
13
Hombre
74
Linfoma de Hodgkin
No evaluado
14
Mujer
144
Linfoma No Hodgkin
Remisión completa
15
Hombre
150
Linfoma linfoblástico
No evaluado
16
Hombre
67
Linfoma Burkitt
Remisión completa
17
Mujer
52
Neuroblastoma
Recidiva
18
Hombre
58
Neuroblastoma
Remisión completa
19
Hombre
17
Histiocitosis sistémica
Recidiva
20
Mujer
7
Tumor Wilms
Progresión
21
Mujer
20
Meduloblastoma
Remisión completa
22
Hombre
130
Meduloblastoma
Remisión completa
23
Mujer
76
Meduloblastoma
Remisión parcial
24
Hombre
71
Meduloblastoma
No evaluado
25n
Hombre
84
Sarcoma Ewing
Progresión
26n
Hombre
85
Sarcoma Ewing
Progresión
27
Mujer
160
Sarcoma Ewing
Progresión
TPH= Trasplante de progenitores hematopoyéticos. L= leucemia.
Tabla II: Estudios microbiológicos realizados
Prueba realizada
Realización
Resultados positivos
Otros datos
Esputo espontáneo
a
22.2% 8 (N=6)
0%
1 contaminado
Antigenuria Legionella
77.8% (N=21)
0%
Antigenuria Neumococo
81.5% (N=22)
0%
VRS en aspirado nasofaríngeo
70.4% (N=19)
21%
Influenza A
62.9% (N=17)
11.7%
Influenza B
59.2% (N=16)
0%
Antigenemia de CMV en sangre
44.4% (N=12)
16.6%
100% casos, pacientes
hematológicos.
Galactomananos en sangre
66.7% (N=18)
22.2%
75% casos, pacientes
hematológicos
FBC con BAL
22.2% (N=6)
50%
Candida albicans
Aspergillus spp
Haemophilus influenza
Hemocultivo
100% (N=27)
25.9%
PAAF
7.4% (N=2)
0%
VRS: Virus respiratorio sincitial BAL: Lavado bronquioalveolar.
a
La edad de los pacientes que se realizó el esputo inducido tuvo una media de 121 meses (67-160 meses)
26
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
midis (5), S.hominis (1) y Pseudomona aeruginosa +
Strenotophomonas maltophila (1).
El resto de estudios para el diagnóstico microbioló-
gico se encuentran resumidos en la tabla II.
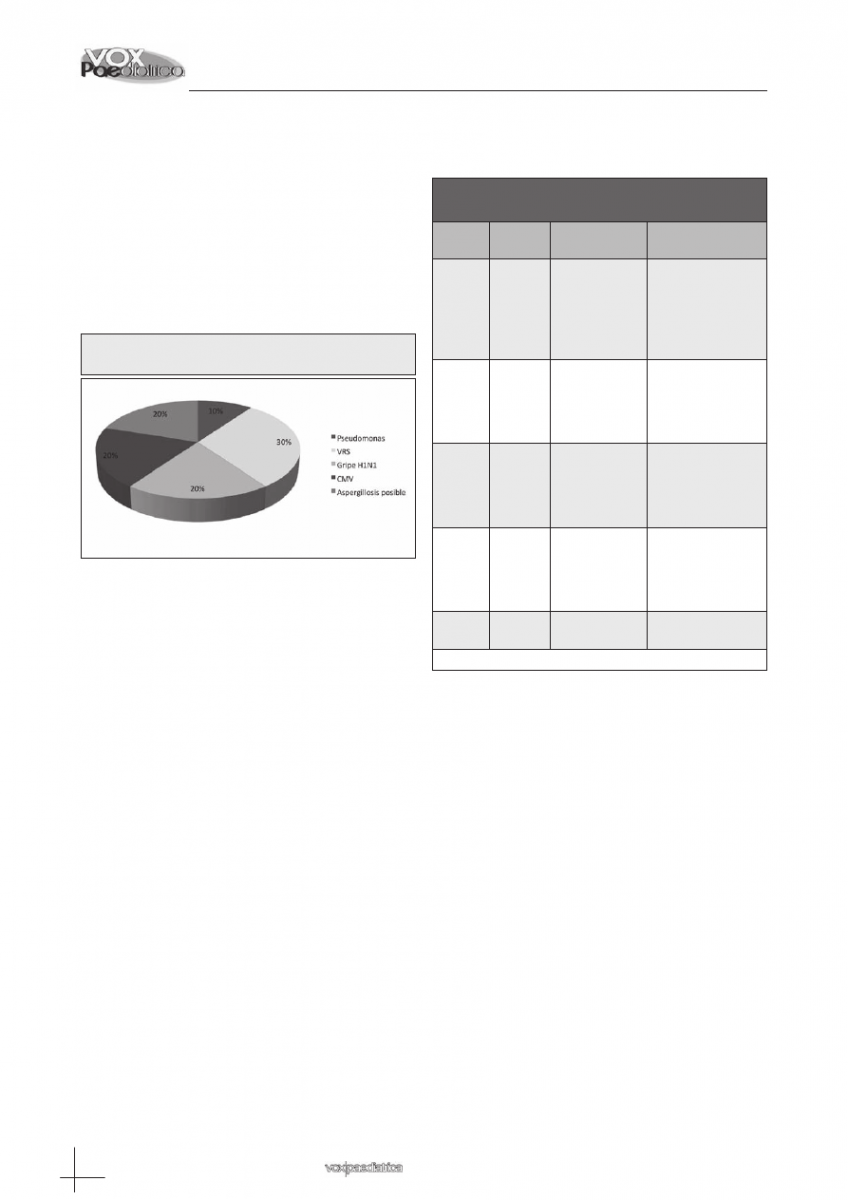
De todos los aislamientos, sólo fueron considerados
causales del cuadro respiratorio los hallazgos en 10 pa-
cientes (37%) y se presentan en el gráfico 1. Sólo en un
paciente se realizó un diagnóstico de certeza (necropsia)
y confirmó la presencia en sangre y pulmón de Pseudo-
monas aeruginosa +Stenotrophomonas maltophila.
Gráfico 1: Aislamientos que fueron considerados
causales en el proceso
Respecto a los procedimientos invasivos, se lleva-
ron a cabo fibrobroncoscopia y lavado bronquioal-
veolar (BAL) sólo en un 22,2% (6 casos). El 50% fue
positivo, encontrándose: Candida albicans, Aspergillus
spp y Haemophilus influenzae. La toma de muestras
de tejido pulmonar, con técnica de punción aspiración
con aguja fina, sólo se realizó en dos pacientes (7,4%),
en ambas se encontraron metástasis de la enfermedad
de base y cultivos negativos.
Respecto al tratamiento etiológico, en el 37% de
los casos se administró la antibioterapia empírica se-
gún el protocolo inicial redactado por un comité espe-
cializado y basado en las últimas evidencias científicas.
Durante la evolución, hasta el 66.7% de los pacientes,
precisaron uno o varios cambios de tratamiento. En
la mayoría de los casos (83%), el cambio se realizaba
ante la no mejoría del paciente; mientras que sólo en un
17%, por la sospecha o el aislamiento de un germen.
Requirieron soporte ventilatorio el 44,4% de los
pacientes. Se intentó ventilación no invasiva (VNI) en
siete pacientes, de los cuales, sólo en uno fue efec-
tiva evitando la intubación. Precisaron Ventilación me-
cánica convencional el 40,7% (11) con una duración
media de 14,8 días (1-43 días). De estos 11 pacientes,
7 (63,6%), requirieron ventilación de alta frecuencia
(VAFO) con una duración media de 4,5 días (0-19 días).
El tiempo de estancia hospitalaria por episodio fue
de 24,48 días (5-110 días) y hasta el 51,9% de los pa-
cientes requirió ingreso en la unidad de cuidados in-
tensivos (UCIP), con una duración media de 18,2 días.
De los 27 pacientes, fallecieron 5 (18,5%): tres por
progresión de la enfermedad y solo dos a causa del
proceso infeccioso. Los diagnósticos definitivos según
la historia clínica y la necropsia se detallan en la tabla III.
Tabla III: Características y causa del éxitus
en los pacientes fallecidos
Paciente
Edad
Enfermedad
base
Causa del éxitus
1
76
meses
Meduloblas-
toma
Sepsis con
infección pulmonar
por Pseudomona
aeruginosa y
Strenotophomonas
maltophila.
2
7 meses
Meduloblas-
toma
Metástasis
pulmonares por
progresión de la
enfermedad de
base
3
160
meses
Sarcoma de
Ewing
Metástasis
pulmonar con
progresión de la
enfermedad de
base
4
85
meses
Sarcoma de
Ewing
Metástasis
pulmonar con
progresión de la
enfermedad de
base
5
192
meses
Linfoma células
B
SDRA secundario a
infección pulmonar
SDRA: Síndrome de distrés respiratorio agudo
Discusión
El objetivo del estudio era conocer la casuística y
características de las infecciones respiratorias en este
grupo de pacientes, ya que no hemos encontrado da-
tos similares en nuestro medio.
La incidencia, relativamente baja respecto a la litera-
tura puede deberse a la exclusión de pacientes que no
ingresaron en la unidad, bien porque el estado clínico
no lo requería o porque fueron atendidos en sus cen-
tros; este hecho podría suponer una selección de los
casos más graves.
En nuestra serie existe una mayor proporción de pa-
cientes con tumores sólidos (65% de los casos), frente
a los que padecían enfermedades hematológicas ma-
lignas. En los diferentes estudios que incluyen ambos
grupos de pacientes suele observarse, sin embargo,
una mayor proporción de pacientes con leucemias
[2]
.
Creemos que en nuestro caso, al desarrollarse el pro-
yecto desde el área de Oncología, había una mayor
atención hacia posibles pacientes a incluir en el estudio
y que, por tanto, esto pueda originar un cierto sesgo.
Respecto al estadio de la enfermedad de base, en
los pacientes oncológicos, la mayoría se encontraban
en remisión completa (38%), seguida de aquellos que
presentaban enfermedad progresiva (25%) y de recidiva
VRS: virus respiratorio sincitial CMV: citomegalovirus

27
Volumen XXI Nº 1 Mayo 2014
D
ÍAZ
F
LORES
M.I.
ET
AL
- I
NFECCIONES
RESPIRATORIAS
GRAVES
EN
PACIENTES
INMUNODEPRIMIDOS
DE
CAUSA
ONCOHEMATOLÓGICA
de la misma (13%). Los estudios han demostrado que
en los pacientes oncológicos, el riesgo es mayor mien-
tras el paciente se encuentra en fase de tratamiento,
pero que al acabar este periodo, la incidencia disminuía
a niveles similares a los de la población general.
[2]
En los pacientes hematológicos, la mayor parte de
los casos se encontraban en el tratamiento de inducción
o reinducción (55%), seguidos de los que realizaban tra-
tamiento de consolidación (30%); lo cual coincide con
otros estudios publicados.
[2, 4]
Esto es debido a la mayor
intensidad del tratamiento quimioterápico y a la presen-
cia de la inmunosupresión por la propia leucemia.
La clínica típica de nuestros pacientes fue la respira-
toria, predominando la tos, hecho que concuerda con
lo hallado por otros autores, y que refleja la inespeci-
ficidad de los hallazgos en un cuadro potencialmente
tan grave.
[2]
En cuanto a los aislamientos, autores como Keen-
gwe
[12]
alcanzan un 27%, mientras que en nuestra revi-
sión hemos identificado hasta un 37%. La etiología se
asemeja a lo descrito por éste y otros autores: nues-
tra serie tiene un predominio de agentes virales, espe-
cialmente los respiratorios (VRS 30%, Influenza 20%).
Siendo menos frecuentes los agentes bacterianos y
fúngicos. En la literatura los virus suponen un 20% de
los casos, que ascendía al 40% si se tenía en cuenta
coinfecciones por otros gérmenes
[12]
. En un estudio
realizado sobre pacientes con fiebre neutropénica, el
57% de los mismos presentaban infecciones por virus
respiratorios, siendo el VRS el más común.
[9]
Ninguno
de nuestros pacientes falleció a causa de infecciones
virales aisladas, aunque sí registramos casos que pre-
sentaron complicaciones como sobreinfección bacte-
riana y SDRA y que han sido descritas por diferentes
autores.
[13, 14]
Se realizaron radiografía simple de tórax en todos los
pacientes, el 85% de los cuales presentaron hallazgos
patológicos. Se llevó a cabo TAC torácico en el 63%
de los casos anteriores, siendo todos patológicos. En
un estudio sobre pacientes pediátricos con infecciones
respiratorias se destacan las ventajas del TAC, tanto de
sensibilidad como de especificidad respecto a la radio-
grafía simple.
[15]
El TAC también ayuda a caracterizar
los infiltrados y si fuese necesario a localizar la zona
para la realización de toma de muestras.
[16,17]
Por lo
que muchos autores recomiendan realizar el TAC de
una manera precoz
[15-17]
.
El hemocultivo fue positivo en un 25.9% de los pa-
cientes, siendo la gran parte Staphylococos coagulasa
negativo, y que atribuimos al amplio uso de dispositi-
vos vasculares y que no son considerados habitual-
mente causantes de infecciones respiratorias.
Es bien conocido el papel de la FBC y el BAL en el
establecimiento del diagnóstico de infección en estos
pacientes
[18]
. La rentabilidad para aislar un agente infec-
cioso en algunas series oscila del 42-53% con una tasa
de complicaciones que alcanza el 30%; este porcentaje
relativamente alto es debido a la gravedad inherente a
los pacientes.
[19]
Algunas series, describen que en niños
imnunocomprometidos de cualquier etiología con infil-
trados pulmonares, la FBC junto al BAL permitía llegar
a un diagnóstico de confirmación hasta en un 83.9%,
con aislamiento de gérmenes en 36%, por lo que con-
cluyen que la FBC debería ser una herramienta diag-
nóstica de uso precoz en pacientes con cuadros res-
piratorios severos.
[20]
La adición a la FBC con BAL de
otras técnicas diagnósticas como el cepillado bronquial
protegido (CBP), el aspirado fibrobronquial o la biopsia
transbronquial supone una escasa mejoría en la renta-
bilidad diagnóstica
[21,22]
; en un subestudio realizado so-
bre la optimización de los distintos procedimientos de la
FBC , el diagnóstico del BAL fue de un 94% (65/69), el
CBP 46% (29/63) y el aspirado fibrobronquial del 74%
(14/19), aunque sólo un caso de CBP no fue diagnósti-
cado por BAL. La biopsia transbronquial se excluyó de
este subanálisis, realizándose en 11 casos (de un total
de 200 pacientes) con una positividad de resultados en
6 (55%), por lo que los autores recomiendan su rea-
lización exclusivamente en casos infiltrados nodulares
localizados
[22]
. Dada el bajo número de nuestra serie,
es difícil establecer comparaciones. La escasez de fi-
brobroncoscopias realizadas, creemos que puede ser
debido a un rápido empeoramiento de los pacientes
(que dificultaría la realización de la técnica), a una baja
concienciación sobre la búsqueda del agente o a pro-
blemas de planificación hospitalaria.
Respecto al pronóstico, nuestra mortalidad fue del
18.5%, aunque solo dos de los pacientes murieron
por la infección respiratoria, ya que los tres restantes
se atribuyeron a su enfermedad de base. En 1992, se
publica una supervivencia del 26% cuando precisan in-
greso en UCIP
[23]
y en 1999, asciende hasta el 44.4%
[12]
. Nuestra supervivencia del 81.5% supone una im-
portante mejoría que atribuimos a un manejo más pre-
coz y agresivo de la infección y a un mayor desarrollo
de las técnicas de soporte. En este sentido la VNI está
cobrando mayor importancia en este tipo de pacientes.
Essouri alcanza un porcentaje de éxito del 97%, aun-
que estos resultados deben ser tomados con cautela,
ya que el número de pacientes era bajo
[24]
. El escaso
éxito en nuestra unidad, creemos que podría estar en
relación al desconocimiento de la técnica (que está su-
friendo actualmente un amplio desarrollo) y a la rápida
evolución de estos pacientes, que en muchos casos no
permite indicarla.
Las infecciones respiratorias graves en pacientes in-
munocomprometidos conllevan una importante morbi-
mortalidad, aunque su supervivencia está en aumento.
La mejora en las técnicas diagnósticas y en la medicina
intensiva abre un camino esperanzador para estos pa-
cientes.

28
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XXI Nº 1 Mayo 2014
Bibliografía
1. Jemal AJ, Siegel R, Ward E, Hao Y, Xu J, Thun
MJ. Cancer Statistics, 2009. 2009. American Cancer
Society. Doi: 10.3322/caac. 20006.
2. Shaw NJ, Elton R, Eden OB. Pneumonia and
pneumonitis in childhood malignancy. Acta Paediatr
1992; 81: 222-6.
3. Castagnola E, Fontana V, Caviglia I, Caruso S,
Faraci M, Fioredda F et alt. A prospective study on the
epidemiology of febrile episodes during chemotherapy-
induced neutropenia in children with cancer or after
hematopoietic stem cell transplantation. Clin Infect Dis
2007; 45: 1296-1304.
4. Salzer W, Dinndorf P, Dreyer ZA, Hilden J, Reaman
GH. Analysis of infectious complications in infants with
acute lymphoblastic leukemia treated on the Children’s
Cancer Group Protocol 1953. J Pediatr Hematol Oncol
2009; 31: 398-405.
5. Pizzo P, Poplack DG. Principles and Practice of
Pediatric Oncology. 6th Ed. Editorial: Lippincott Wil-
liams & Wilkins. 2010. p.1190-1242.
6. Bergen GA, Shelhamer JH: Pulmonary infil-
trates in the cáncer patient: New approaches to an old
problem. Infect Dis Clin North AM 1996; 10: 297-325.
7. Bailey L, Reilly A, Rheingold S. Infections in pedi-
atric patients with hematologic malignancies. Semin
Hematol 2009 Jul; 46: 313-24.
8. Koskenvuo M, Möttönen M, Rahiala J, Saarinen-
Pihkala U, Riikonen P, Waris M et alt. Respiratory Viral
Infections in children with leukemia. Pediatr Infect Dis J
2008; 27: 974-980.
9. Torres JP, Labraña Y, Ibañez C, Kasaneva P,
Farfán M, De la Maza V et alt. Frecuency and clinical
outcome of respiratory viral infections and mixed viral-
bacterial infections in children with cancer, fever and
neutropenia. Pediatr Infect Dis J. 2012; 31: 889-893.
10. El Saleeby C, Somes GW, De Vincenzo JP, Gaur
A. Risk factors for severe Respiratory Syncytial Virus
disease in children with cancer: the importance of lym-
phopenia and young age. Pediatrics 2008. 121; 2: 235-
243.
11. Neville K, Renbarger J, Dreyer Z. Pneumonia in
the immunocompromised pediatric cancer patients.
Semin Respir Infect 2002; 17: 21-32.
12. Keengwe I, Stansfield F, Eden O, Nelhans N,
Dearlove O, Sharples A. Paediatric oncology and inten-
sive care treatments: changing trends. Arch Dis Child
1999; 80: 553-555.
13. El-Mahallawy HA, Ibrahim MH, Shalaby L, Kandil
A. Community respiratory viruses as a cause of lower
respiratory tract infections following suppressive che-
motherapy in cáncer patients. J Egypt Natl Canc Inst.
2005; 17: 121-126.
14. Libster R, Bugna J, Coviello S, Hijano DR,
Dunaiewsky M, Reynoso N et alt. Pediatric hospital-
izations associated with 2009 pandemic influenza A
(H1N1) in Argentina. N Engl J Med 2009; 362: 45-55.
15. Heussel CP, Kauczor HU, Heussel G, Fischer B,
Mildenberger P, Thelen M. Early detection of pneumonia
in febrile neutropenic patients: use of thin-section CT.
Am J Roentgenol. 1997; 169: 1347-53.
16. Copley SJ. Application of computed tomography
in childhood respiratory infections. Br Med Bull. 2002;
61: 263-79.
17. Heussel CP. Importance of pulmonary imaging
diagnostics in the management of febril neutropenic
patients. Mycoses. 2011; 54 (Suppl 1): 17-26.
18. Ratjen F, Costabel U, Havers W. Differential
cytology of bronchoalveolar lavage fluid in immunosup-
pressed children with pulmonary infiltrates. Arch Dis
Child. 1996; 74: 507-511.
19. Num Efrati O, Gonik U, Bielorai B, Modan-Moses
D, Neumann Y, Szeinberg A et alt. Fiberoptic bronchos-
copy and bronchoalveolar lavage for the evaluation of
pulmonary disease in children with primary immundo-
deficiency and cáncer. Pediatr Blood Cancer 2007; 48:
324-329.
20. Efrati O, Sadeh-Gornik U, Modan-Moses D,
Barak A, Szeinberg A, Vardi A et alt. Flexible bronchos-
copy and bronchoalveolar lavage in pediatric patients
with lung disease. Pediatr Crit Care Med. 2009; 10:
80-4.
21. Jain P, Sandur S, Meli Y, Arroliga AC, Stoller JK,
Mehta AC. Role of flexible bronchoscopy in immu-
nocompromised patients with lung infiltrates. Chest.
2004; 125: 712-22.
22. Raño A, Agustí C, Jiménez P, Angrill J, Benito N,
Danés C et al. Pulmonary infiltrates in non-HIV immu-
nocompromised patients: a diagnostic approach using
non-invasive and bronchoscopic procedures. Thorax.
2001; 56: 379-87.
23. Heney D, Lewis IJ, Lockkwood L. The intensive
care unit in paediatric oncology. Arch Dis Child 1992;
67: 294-298.
24. Essouri S, Chevret L, Durand P, Hass V, Fauroux
B, Devictor D. Non invasive positive pressure ventilt-
ation: five years of experience in a pediatric intensive
care unit. Pediatr Crit Care Med. 2006; 7: 329-34.
| Adjunto | Tamaño |
|---|---|
| voxpaed21.1pags22-28.pdf | 149.29 KB |



