![]()
Debut de diabetes mellitus tipo 1 en el área hospitalaria de Valme
La Diabetes Mellitus tipo 1 (DM1), o diabetes insulino-dependiente, es la enfermedad crónica endocrinológica más frecuente en la edad pediátrica y la segunda enfermedad crónica en la infancia después del asma en países desarrollados. La etiopatogenia es compleja, presentándose en una población genéticamente susceptible, de herencia poligénica (haplotipo HLA), expuesta a factores ambientales, aún no del todo conocidos.
Objetivos: Analizar aspectos epidemiológicos en el debut de un grupo de niños con DM1 en el periodo 1998-2009.
Material y métodos: Se revisa en nuestra base de datos todos los niños menores de 14 años que han acudido al hospital con debut de DM1 durante los años 1998-2009. Se aplica un protocolo de recogida de datos y se realiza un estudio observacional retrospectivo.
Resultados: Se revisan 106 historias clínicas de niños menores de 14 años, diagnosticadas de DM1, el 50% son niños y el 50% son niñas. Un 50% tenían menos de 8 años cuando debutaron. La edad media del debut fue de 8 años + 5 meses ± 3 años +3 meses. Se observa mayor número de debut en invierno, 38 casos (35,8%), seguido de primavera. De todos los casos un 34,9% (37 niños) presentan antecedentes personales de interés. Un 73,6% (78 casos) presentan algún familiar de primer o segundo grado con DM1 o DM2.
Conclusiones: La incidencia de debut de diabetes no muestra diferencias entre sexos, aumentando a mayor edad. Existe una estacionalidad evidente en invierno, seguida de primavera. Un porcentaje importante de pacientes presentan antecedentes familiares de Diabetes tipo 1 y/o Diabetes tipo 2.
The Diabetes Mellitus type 1 (DM1), or insulindependent diabetes, is the most frequent chronic endocrinological disease in the paediatric age and the second chronic disease in the infancy after the asthma in developed countries. The etiopatogenia is complex, appearing in a genetically capable population, of inheritance poligénica (haplotipo HLA), exposed to environmental factors, still not completely known.
Aims: epidemiological aspects analyze in the début of a group of children with DM1 in the period 1998-2009.
Material and methods: It is checked in our database all the 14-year-old minor children who have come to the hospital with début of DM1 during the years 1998-2009. There is applied a protocol of withdrawal of information and a study is realized observacional retrospectively.
Results: there are checked 106 clinical histories of 14-year-old minor children, diagnosed of DM1, 50% is children and 50% is girls. 50 % had less than 8 years when they made début. The middle ages of the début are 8 years + 5 months ± 3 years +3 months. Major number of début is observed in winter, 38 cases (35,8 %), followed by spring. Of all the cases 34,9 % (37 children) presents personal precedents of interest. 73,6 % (78 cases) presents some relative of the first or second degree with DM1 or DM2.
Conclusions: The incident of début of diabetes does not show differences between sexes, increasing to major age. An evident seasonal variation exists in winter, followed by spring. An important percentage of our patients present familiar precedents of Diabetes type 1 and / or Diabetes type 2.

10
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
Introducción
L
a Diabetes Mellitus tipo 1 (DM1), o diabetes insu-
linodependiente, es la enfermedad crónica endo-
crinológica más frecuente en la edad pediátrica y
la segunda enfermedad crónica en la infancia después
del asma en países desarrollados
1,2
. El proceso autoin-
mune se dirige específicamente contra las células
? de
los islotes pancreáticos, produciendo una destrucción
de éstos y un déficit de insulina. La etiopatogenia es
compleja, presentándose en población genéticamente
susceptible
3,4
, expuesta a factores ambientales, aún no
del todo conocidos
2
.
La incidencia ha experimentado un incremento de
casos en el mundo a partir de 1960
5
, en España os-
cila entre 7 y 38.7 casos por cada 100000 habitantes
menores de 15 años
6-9
. A nivel mundial se han des-
crito amplias variaciones geográficas, que varía de
0,1/100.000 por año en China
10
a más de 38/100.000
por año en Cerdeña
11
y 45/100.000 por año en Finlan-
dia
12
. En líneas generales, la incidencia es mayor en po-
blaciones de origen europeo y caucásico, incluyendo
países de Europa, Estados Unidos y Canadá. Otros
países con alto porcentaje de población caucásica tie-
nen la incidencia más alta de sus respectivas regiones,
tales como Argentina y Uruguay en América del Sur
y Australia y Nueva Zelandia en el Pacífico Occiden-
tal. Por otra parte, la incidencia es baja en países con
una proporción elevada de otros grupos étnicos, tales
como México, Perú y China
13
.
Con el registro europeo EURODIAB
14
se ha obser-
vado un aumento de la incidencia de forma desigual
por edades y países. El incremento anual varía del
0.6% en España hasta el 9.3% en Polonia.
Existen pocos estudios que evalúen la prevalencia de
DM1
13
y los datos deben ser interpretados con precau-
ción dado que abarcan diferentes períodos de tiempo,
áreas geográficas limitadas y emplean diferentes defini-
ciones y métodos para recolectar la información.
En el año 2000, la OMS estima una prevalencia del
0.03% en todo el mundo y 0.15% en países desarro-
llados para una población menor de 20 años
15
. En Es-
paña se sitúa entre 0,3 y 1,53 casos cada 1000 meno-
res de 15 años.
La incidencia aumenta con la edad, alcanzando el
pico en la pubertad, que supone el 50-60% de los ca-
sos
16,17
.
Los datos de DIAMOND han mostrado que los ni-
ños de 5 a 9 años tienen un riesgo 1.62 veces mayor
(95% intervalo de confianza (IC: 1.57- 1.66) y que entre
10 y 14 años presentan un riesgo 1.94 veces mayor
(95% IC: 1.89-1.98) comparados con el grupo etáreo
de 0 a 4 años
13
. En la última década se ha observado
un aumento de nuevos casos en niños menores de 4
años, describiéndose un incremento medio de 3.9%
cada año, siendo un 5.4% a expensas de este grupo
14
.
La distribución por sexo es similar en los niños. Un
leve predominio en el sexo masculino ha sido recogido
en poblaciones europeas, con un reducido predominio
femenino en poblaciones afroasiáticas.
Se observa cierta estacionalidad al debut, con un
pico de nuevos casos en invierno, característica obser-
vada en ambos sexos y en todos los grandes grupos
étnicos, siendo más pronunciada en aquellos países
con diferencias marcadas entre las temperaturas de in-
vierno y verano
18
. Esta diferente estacionalidad también
la presentan al nacimiento en comparación con la po-
blación general.
Objetivos
Analizar aspectos epidemiológicos en el debut de un
grupo de niños con DM1 en el periodo 1998-2009.
Material y Métodos
Estudio observacional retrospectivo en el periodo
1998-2009, de los casos de debut de DM1 en niños
menores de 14 años de edad y posterior seguimiento.
Se revisa en nuestra base de datos todos los niños
menores de 14 años que han acudido al Hospital con
debut de DM1 durante los años 1998-2009 y poste-
riormente se realiza un seguimiento en consultas exter-
nas de Endocrinología Infantil, cada 3-4 meses, hasta
cumplir los 14 años. Se revisan las historias clínicas de
los casos (Archivos centrales del área) y se aplica un
protocolo de recogida de datos epidemiológicos al de-
but (sexo, incidencia, edad, estacionalidad y antece-
dentes familiares de DM1 y 2)
Metodología estadística:
Análisis descriptivo realizado con el programa
SPSS.14.
Las variables cuantitativas se expresan con medias y
desviaciones típicas o, si las distribuciones son asimé-
tricas, con medianas y percentil (P25 y P75), mientras
que las variables cualitativas con tablas de frecuencia
y porcentaje.
Este análisis se realiza sobre la muestra global, así
como por subgrupos de edad (<5 años, 5-10 años, 10-
14 años) y por sexo (varón, mujer). Se acompaña de
representaciones gráficas según el tipo de información
(histograma de frecuencias y diagrama de sectores)
Resultados
Se revisan 106 historias clínicas de niños menores
de 14 años, diagnosticadas de DM1.
– Sexo
De los 106 pacientes con DM1, el 50% (53 casos)
son niños y el 50% (53 casos) son niñas.
– Incidencia
De una población de 400.000 habitantes que acude
11
Volumen XIX Nº 1 Abril 2012
D
EBUT
DE
DIABETES
MELLITUS
TIPO
1
EN
EL
ÁREA
HOSPITALARIA
DE
V
ALME
al hospital, 65.000 son menores de 14 años. Se ob-
serva una incidencia de 13.5 casos/año/100.000.
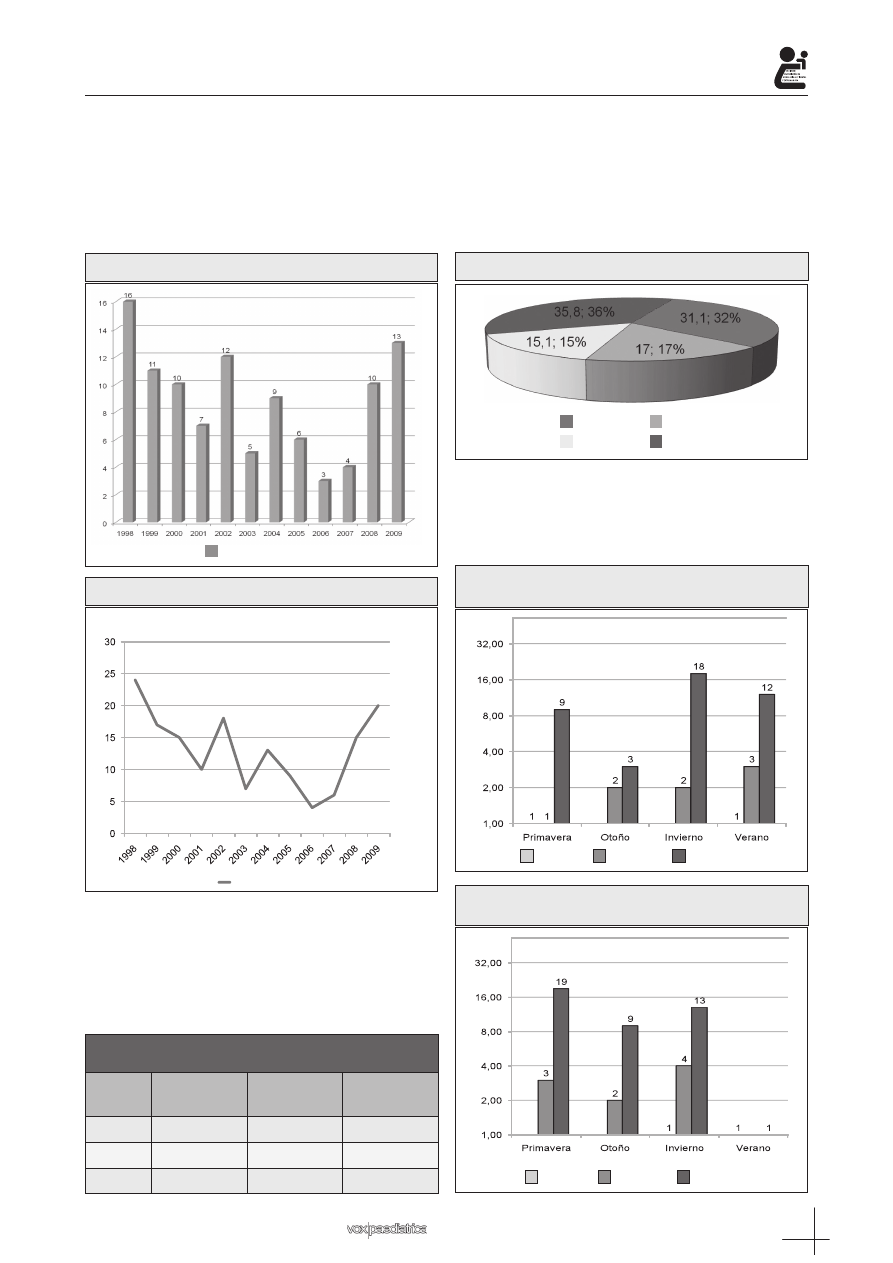
En las siguientes gráficas presentamos el número
de casos y la incidencia con la que debutan cada año
(Figura 1 y 2).
Figura 1: Número de debut por año
Figura 2: Incidencia de debut por año
– Edad
Se dividen por grupos de edad (Tabla I). Un 50%
tenían menos de 8 años cuando debutaron (mediana).
Un 25% eran menores de 5 años (P25) y un 25% tenían
más de 11 años (P75). La edad media del debut es de
8 años + 5 meses ± 3 años +3 meses.
Tabla I. Número de casos por sexo y grupo de edad
Edad
(años)
Mujer
(nºcasos %)
Varón
(nºcasos%))
Total
(nºcasos (%))
<5
2 (3,8)
2 (3,8)
4 (4)
5-10
8 (15,1)
9 (17)
17 (16)
>10<14
43 (81,1)
42 (79,2)
85 (80)
– Estación
Se observa mayor número de debut en invierno, 38
casos (35,8%), seguido de primavera 33 casos (31,1%).
En menor número observamos el verano con 18 casos
(17%) y el otoño con 16 casos (15,1%) (Figura 3).
Figura 3: Número de casos por estación
Se compara el número de casos por edad que de-
butan en diferentes estaciones según sexos, mujeres
(Figura 4) y varones (Figura 5). Se observan diferen-
cias entre sexos en las diferentes estaciones (Tabla 2).
Figura 4: Numero de casos por grupo de edad en
cada estación en las mujeres
Figura 5: Número de casos por grupo de edad en
cada estación en los varones
Número de casos
Incidencia
Incidencia
Primavera
Verano
Otoño
Invierno
5-10 años
<5 años
>10 años
5-10 años
<5 años
>10 años
12
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 1 Abril 2012
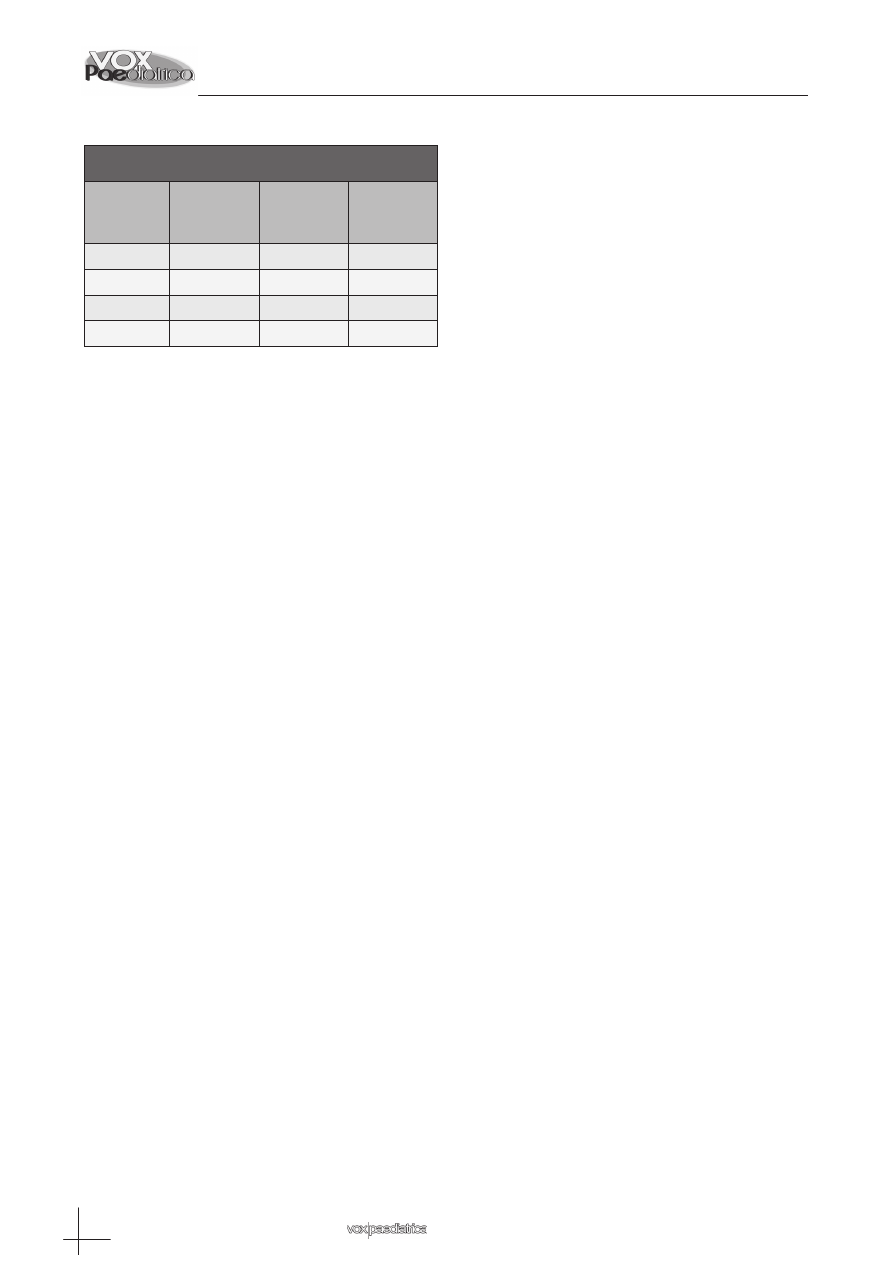
Tabla 2. Número de casos por sexo y por estación
Estación
Mujer
(nºcasos
(%))
Varón
(nºcasos
(%))
Total
(nºcasos
(%))
Primavera
11 (20,8)
22 (41,5)
33(31,1)
Verano
16 (30)
2 (3,8)
18(17)
Otoño
5 (9,4)
11 (20,8)
16 (15,1)
Invierno
20(37,7)
18(34)
38(35,8)
– Antecedentes familiares
Un 73,6% (78 casos) presentan algún familiar de pri-
mer o segundo grado con DM1 o DM2. 42,3% (33 ca-
sos) son mujeres y 57,6% (45 casos) son varones.
El porcentaje de antecedentes familiares de DM2 es
algo superior al de DM1, 65,3% (51 casos) con DM2
frente al 43,5% (34 casos) con DM1. Los casos con
antecedentes familiares de DM1 no presentan diferen-
cia entre sexos, mientras que los que presentan ante-
cedentes de DM2, un 62,4% son varones y un 37,2%
son mujeres.
Discusión
Se revisan 106 historias clínicas de niños menores
de 14 años diagnosticados de DM1 en nuestro hospital
en el periodo 1998-2009.
De los 65.000 niños menores de 14 años que atiende
nuestra área sanitaria, 106 debutaron con DM1 en un
periodo de 12 años, lo que supone una incidencia de
13.5 casos/año/100.000 habitantes menores de 14
años. Estas cifras entran dentro del rango de inciden-
cia descrito en España
6-9
. De todos los casos, 50% son
niños y 50% niñas, una distribución por sexo similar a
la descrita. La edad media del debut es de 8 años + 5
meses, se describe mayor prevalencia a mayor edad,
con un pico de incidencia en la edad puberal del 50-
60%
16,17
. En la última década se ha observado un au-
mento de nuevos casos en niños menores de 4 años
14
,
se desconoce una etiología clara que explique este in-
cremento. Existen diferentes factores genéticos y am-
bientales involucrados. Diversos estudios han descrito
que actualmente existiría una mayor penetrancia de los
alelos relacionados con diabetes, lo que ha sido atri-
buido en parte a interacción con inmunizaciones reci-
bidas en la infancia. Un estudio reciente sugiere que la
ganancia precoz de peso, así como el elevado índice
de masa corporal en niños pequeños, puede predis-
ponerlos a una temprana insulinorresistencia y destruc-
ción de células
?, lo que conlleva a una mayor inci-
dencia de DM1 en este grupo. No existen trabajos que
avalen con evidencia suficiente la causalidad de estos
factores En nuestra serie el grupo menor de 5 años re-
presenta el 3,7% del total, debutando un 25% en 2007
y un 75% en 2009.
Existe estacionalidad, con un pico en invierno, en
ambos sexos
17
, coincidiendo con nuestra serie, un
35,8% de casos debutan en invierno (34% varones/ 37
% mujeres), con ligera diferencia a favor del sexo feme-
nino. En las otras estaciones las diferencias por sexo
son más importantes. Está descrita la influencia de fac-
tores climáticos (frío) sobre la aparición de infecciones
víricas siendo ésta la causa por la que regiones más
cercanas al polo presentan mayor incidencia de DM1,
con la excepción de Cerdeña. Estudios retrospectivos
han proporcionado resultados dispares sugiriendo que
infecciones inespecíficas previas al comienzo de la en-
fermedad pueden asociarse con un riesgo aumentado,
mientras que la concurrencia preescolar diaria con ma-
yor posibilidad de una carga infecciosa precoz, desem-
peñaría un papel protector.
Se observa asociación con virus del grupo enterovi-
rus
19
. También se han detectado anticuerpos relaciona-
dos con los islotes después de infecciones por paroti-
ditis, sarampión, varicela y rotavirus
20
.
Un 73,6% presentan algún familiar de primer o se-
gundo grado con DM1 o 2. Los antecedentes familiares
de DM2 (65,3%) son algo superior al de DM1 (43,5%).
43,5% tienen antecedentes familiares de DM1, se sabe
que en los gemelos homocigotos la concordancia en
el caso de la DM1 alcanza un 50%, lo que sugiere que
tanto factores genéticos como ambientales, influyen
en el desarrollo de la enfermedad. Estudios en pacien-
tes con DM1 han demostrado que sus hijos tienen un
riesgo 4-14 veces mayor que la población general de
presentar DM1, especialmente cuando la DM1 la pre-
senta el padre. En el caso de la madre, la asociación es
más débil y no significativa. No todos los casos tienen
antecedentes familiares de DM1, justificando el modelo
de la historia natural, en el que individuos susceptibles
genéticamente con un número fijo de células
?, están
expuestos a un desencadenante ambiental que induce
la autoinmunidad de la célula. El principal locus de sus-
ceptibilidad a DM1 se encuentra en la región HLA en el
brazo corto del cromosoma 6 y contribuye con aproxi-
madamente el 40-50% del riesgo heredado de DM1,
los genes de clase II (DQ, DR y DP) representan la aso-
ciación más fuerte con la enfermedad
21, 22
.
Conclusiones
La incidencia de debut de diabetes no muestra dife-
rencias entre sexos.
A mayor edad, mayor número de casos debutan con
Diabetes tipo 1.
Existe una estacionalidad evidente con mayor fre-
cuencia en invierno seguida de la primavera.
Un porcentaje importante de nuestros pacientes
presentan antecedentes familiares de Diabetes tipo 1
y/o Diabetes tipo 2.

13
Volumen XIX Nº 1 Abril 2012
D
EBUT
DE
DIABETES
MELLITUS
TIPO
1
EN
EL
ÁREA
HOSPITALARIA
DE
V
ALME
Bibliografía
1. Goday A, Castell C, Tresserras R, Cano JF, Llo-
veras G. Epidemiología de la diabetes mellitus tipo 1.
Endocrinología 1992; 36: 26-40.
2. David G, Leslie D, Elliot R. Early environmental
events as a cause of IDDM. Evidence and implications.
Diabetes 1994; 43: 843-50.
3. Wagner AM, Mauricio D, Argente J, et al. Y el
grupo de estudio de la red Europea de Genética de la
diabetes tipo 1 y del consorcio internacional de gené-
tica de la diabetes tipo 1. Red de Europa de Genética
de la diabetes tipo 1. Endocrinología y Nutrición 2005;
52: 117-83.
4. Gale EAM: The Rise of childhood type 1 diabetes
in the 20
th
century. Diabetes: 2002; 5.
5. Giralt Muiña P, Urra Ardanaz JM, Sanabria Pérez
C, et al. Diferencias biológicas en la presentación de la
diabetes A1, en relación con los marcadores genéticos
HLA-DQ. Med Clin (Barc) 2003; 120:6-9.
6. Cepedano Dans A, Barreiro Conde J, Pombo Arias
M y grupo de diabetes infantil de Galicia. Incidencia y
características clínicas al manifestarse la diabetes
mellitas 1 en niños de Galicia (España, 2001-2002). An
Pediatr (Barc) 2005; 62: 123-7.
7. Del Pino de la Fuente A, López Sigueiro JP. Varia-
ción de la incidencia de diabetes mellitas tipo 1 en
niños menores de 14 años en la provincia de Málaga
(1982-2002). An Pediatr (Barc) 2003; 58Supl2:118-38.
8. Luzuriaga C, San Román M, Argumosa A, et al.
Aspectos epidemiológicos de la diabetes mellitas tipo
1. Bol Pediatr 2002;:42: 283-95.
9. Bahillo Curieses MP, Hermoso López F, García
Fernández JA, et al. Incidence and prevalence of type
1 diabetes in children aged < 15 years in Castilla-León
(Spain). Pediatric Diabetes. 2007; 8: 369-73.
10. Lambert AP, Gillepie KM, Thonson G. Absolute
risk of childhood-onset type 1 diabetes defined by
human leukocyte antigen class II genotipe: a population
based study in the United Kingdom. JCEM 2004; 89:
4037-43.
11. Casu A, Pascutto C, Bernardinelli L, Songini M.
Type 1 diabetes among Sardinian children is increasing:
the Sardinian diabetes register for children aged 0-14
years (1989-1999). Diabetes Care 2004; 27: 1623-9.
12. Podar T, Solntsev A, Karvonen M, Padaiga Z,
Brigis G, Urbonaite B, Biik-Kajander M Reunanen A,
Akerblom HK, Kaar ML. Prevalence and ten-year (1970-
1979) incidence of insulin-dependent diabetes melitus
in children and adolescents in Finland. Acta Pediátrica
Scandinava 1982; 71: 893-9.
13. The DIAMOND Project Group. Incidence and
trends of childhood Type 1 diabetes worldwide 1990-
1999. Diabetic Medicine 2006; 23: 857-66.
14. Patterson CH, Dahlquist G, Gyurus E, Green A,
Soltész, EURODIAB STUDY GROUP. Incidence trends
for childhood type 1 diabetes in Europe during 1989-
2003 and predicted new cases 2005-20: a multicentre
prospective registration study. Lancet 2009;373:2027-
2033.
15. Wild S, Roglic G, Green A, et al. Global preva-
lence of diabetes: estimates for the year 2000 and pro-
yections form 2030. Diabetes Care 2004; 27: 1047-53.
16. Devendra D, Liu E, Eisenbacth GS. Type 1 dia-
betes. Recent developments. BMJ 2004; 364: 1699-
700.
17. Barker JM, Barriga KJ, Yu L. et al. Prediction
of autoantibody positivity and progression to type 1
diabetes: Diabetes autoinmunity study in the young
(DAYSY) S. Clin Endocrinol Metab 2004; 89:3896-902.
18. Levy-Marchal C, Patterson C, Green A; on behalf
of the EURODIAB ACE Study Group. Variation by age
group and seasonality at diagnosis of childhood IDDM
in Europe. Diabetologia 1995; 38: 823-30.
19. Hyoty H. Environmental causes: viral causes.
Endocrinology and Metabolism Clinics of North Ame-
rica 2004; 33: 27-44.
20. Honeyman MC, Coulson BS, Stone NL et al.
Association between rotavirus infection and pancreatic
islet autoinmunity in children at risk of developing type
1 diabetes. Diabetes 2000; 49(8): 1319-24.
21. Bilbao JR, Calvo B, Urrutia I et al. Bases gené-
ticas de la diabetes tipo 1. Endocrinología 1996; 43:
312-20.
22. Bilbao JR, Calvo B, Aransay AM et al. Conserved
extended haplotypes discriminate se. Genes Immun
2006; 7: 550-54.
| Adjunto | Tamaño |
|---|---|
| voxpaed19.1pags9-13.pdf | 341.26 KB |



