![]()
Enfermedad celíaca: nuevos criterios diagnósticos
La definición y criterios diagnósticos de la enfermedad celíaca (EC) han sido revisados recientemente por la sociedad europea de gastroenterología, hepatología y nutrición pediátricas (ESPGHAN) tras dos décadas sin ser modificados. Establece dos grandes grupos de pacientes, sintomáticos y asintomáticos o de riesgo, con diferente estrategia diagnóstica. Delimita el valor diagnóstico de las diferentes pruebas serológicas y de los marcadores genéticos. Además posibilita por primera vez que en algunos casos bien definidos pueda, a criterio del gastroenterólogo pediátrico, obviarse la biopsia intestinal.
The definition and diagnostic criteria for celiac disease (CD) have been reviewed recently by the European Society of Gastroenterology, Hepatology and Pediatric Nutrition (ESPGHAN) after two decades without being modified. Establishes two groups of patients, symptomatic and asymptomatic or risk, with different diagnostic strategy. Delimits the diagnostic value of different serological and genetic markers. It also allows for the first time in some well-defined cases may, at the discretion of the pediatric gastroenterologist, intestinal biopsy obviated.

28
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
Enfermedad celíaca:
nuevos criterios diagnósticos
Miranda Díaz M., Alonso Romero L., De Castro Ochoa M., Millán Jiménez A.
Sección de Gastroenterología Pediátrica
Unidad de Gestión Clínica de Pediatría y Neonatología
Hospital Universitario de Valme - Sevilla
Resumen: La definición y criterios diagnósticos de la enfermedad celíaca (EC) han sido revisados recien-
temente por la sociedad europea de gastroenterología, hepatología y nutrición pediátricas (ES-
PGHAN) tras dos décadas sin ser modificados. Establece dos grandes grupos de pacientes,
sintomáticos y asintomáticos o de riesgo, con diferente estrategia diagnóstica. Delimita el valor
diagnóstico de las diferentes pruebas serológicas y de los marcadores genéticos. Además posi-
bilita por primera vez que en algunos casos bien definidos pueda, a criterio del gastroenterólogo
pediátrico, obviarse la biopsia intestinal.
Palabras clave: enfermedad celíaca, criterios diagnósticos, biopsia intestinal, niños.
Abstract: The definition and diagnostic criteria for celiac disease (CD) have been reviewed recently by the
European Society of Gastroenterology, Hepatology and Pediatric Nutrition (ESPGHAN) after two
decades without being modified. Establishes two groups of patients, symptomatic and asymp-
tomatic or risk, with different diagnostic strategy. Delimits the diagnostic value of different serolo-
gical and genetic markers. It also allows for the first time in some well-defined cases may, at the
discretion of the pediatric gastroenterologist, intestinal biopsy obviated.
Key words: celiac disease, diagnostic criteria, intestinal biopsy, children.
Recibido: 25-09-2012 Aceptado: 22-10-2012
Vox Paediatrica 2012; XIX(2):28-33
Introducción
L
os avances y precisión en las pruebas inmuno-
lógicas, así como el conocimiento de la implica-
ción y predisposición genética en la enfermedad
celíaca (EC) han permitido a la sociedad europea de
gastroenterología, hepatología y nutrición pediátricas
(ESPGHAN) revisar los criterios diagnósticos de esta
enfermedad
1
. Durante más de 20 años habían prevale-
cido la definición y los criterios diagnósticos previos. En
este artículo revisamos los cambios introducidos y los
algoritmos diagnósticos publicados.
Definición
La enfermedad celíaca queda definida como un tras-
torno inmunitario sistémico mediado por el gluten y
prolaminas relacionadas, en individuos genéticamente
predispuestos y caracterizado por la presencia de una
combinación variable de manifestaciones clínicas de-
pendientes del consumo de gluten, anticuerpos especí-
ficos, haplotipos HLA-DQ2 o HLA-DQ8 y enteropatía
1
.
Con esta definición se modifica el concepto previo
de rara enteropatía y pasa a ser considerada una pa-
tología común, más amplia y extendida, con manifes-

29
Volumen XIX Nº 2 Noviembre 2012
E
NFERMEDAD
C
ELÍACA
:
NUEVOS
CRITERIOS
DIAGNÓSTICOS
taciones multiorgánicas. Además se potencia el papel
de la asociación genética que permite o no desarrollar
la enfermedad. Algunos de los anticuerpos utilizados
para el diagnóstico dejan de ser cuestionados, sobre
todo en su especificidad, y son considerados fiables y
accesibles.
Diagnóstico
En el trabajo publicado por la ESPGHAN se valoran
y reconsideran los cuatro pilares o herramientas diag-
nósticas clásicas: clínica, anticuerpos, genética y ana-
tomía patológica.
Clínica
Claramente establece dos grandes grupos de pa-
cientes en los que hay que establecer o descartar el
diagnóstico de EC: sintomáticos (Tabla I) y asintomáti-
cos o de riesgo (Tabla II).
Los pacientes sintomáticos representan la punta del
“iceberg” de la EC. Por tanto será necesaria la bús-
queda de síntomas que nos hagan sospecharla, cono-
cer los grupos de riesgo y las enfermedades que pue-
den estar asociadas
2
.
En el niño pequeño la clínica más frecuente es la
diarrea crónica, falta de apetito, dolor abdominal re-
currente, irritabilidad, apatía y tristeza. Los signos más
frecuentes son la malnutrición, la distensión abdominal,
la hipotrofia muscular, el retraso pondero-estatural, la
anemia ferropénica y la hipoproteinemia.
En el niño mayor y el adolescente puede no mani-
festarse con síntomas digestivos y presentarse como
anemia ferropénica, estreñimiento, dolor abdominal,
menarquia retrasada, irregularidades menstruales, ce-
faleas, artralgias y hábito intestinal irregular. Los signos
más frecuentes son talla baja, aftas orales, hipoplasia
del esmalte, distensión abdominal, debilidad muscular,
artritis, osteopenia y queratosis folicular. La dermatitis
herpetiforme, expresión cutánea de la EC, podemos
encontrarla más a menudo en niños mayores, adoles-
centes y adultos jóvenes
3
.
Es importante tener en cuenta las formas mono-
sintomáticas por su mayor frecuencia de presen-
tación. La dispepsia con mala respuesta al trata-
miento empírico con procinéticos o que se asocia a
aftas bucales, astenia, cambios de humor o irritabili-
dad. El síndrome de intestino irritable, especialmente
cuando predomina la diarrea como síntoma prin-
cipal. El dolor abdominal crónico y recurrente. Sín-
tomas extradigestivos como pérdida de peso, do-
lores articulares, historia de fracturas, infertilidad,
abortos recurrentes, astenia, ansiedad y depresión.
Existen, además, otras situaciones que hacen necesa-
rio descartar la EC como malnutrición, edemas perifé-
ricos, talla baja, neuropatía periférica, disminución del
tiempo de protrombina, déficit de ácido fólico y vita-
mina B12 e hipertransaminasemia entre otros
2
.
Los pacientes asintomáticos o de riesgo incluyen los
familiares de enfermos celíacos de primer grado, pre-
valencia de EC del 5-15%, y los pacientes de enferme-
dades asociadas a EC como diabetes mellitus tipo I,
tiroiditis autoinmune, déficit selectivo de IgA, enferme-
dad inflamatoria intestinal, algunos trastornos neuroló-
gicos y cromosomopatías como el síndrome de Down
1
.
Anticuerpos
Establece dos grupos en función de su especificidad
1
:
– Anticuerpos con gran especificidad:
Anticuerpos anti endomisio (EMA): su evaluación
requiere la utilización de microscopio y está sujeto a la
variabilidad interobservador. A pesar de estas limitacio-
nes la especificidad de estos anticuerpos, en manos
de laboratorios expertos, está entre el 98 y el 100%.
Por este motivo son considerados los anticuerpos de
referencia.
Anticuerpos anti transglutaminasa tipo 2 (anti-TG2):
su especificidad está condicionada por el título detec-
tado. Altos niveles suelen ser específicos de EC pero
títulos bajos se han detectado también en otras enfer-
medades autoinmunes, infección, tumores, enferme-
dades cardiacas o hepáticas y psoriasis. De ahí que
deba confirmarse con la determinación de EMA.
– Anticuerpos relativamente específicos:
Anticuerpos anti péptidos de gliadina deami-
nada (anti-DGP): aunque su sensibilidad es mayor que
la de EMA o anti-TG2 en pacientes menores de dos
años su baja especificidad por encima de esta edad no
ayuda en el diagnóstico. Por lo tanto no parece reco-
mendable su utilización en la aproximación diagnóstica
en mayores de dos años de edad
4
.
Para una correcta valoración de los resultados obte-
nidos al determinar el nivel de anticuerpos es necesario
tener en cuenta las siguientes premisas:
– Nivel de inmunoglobulina A (IgA): valores inferio-
res a 0,2 gr/L obligan a considerar el resultado y so-
licitar anticuerpos del tipo inmunoglobulina G (IgG).
– Administración de inmunosupresores o corticoi-
des que puedan condicionar la respuesta inmu-
nológica.
– Contenido de gluten en la dieta, ya que un bajo
aporte puede ocasionar falsos negativos
Genética
La susceptibilidad genética para el desarrollo de la
EC está fuertemente asociada a genes del complejo
mayor de histocompatibilidad, HLA tipo II, codificados
en el cromosoma 6. Así más del 95% de los pacien-
tes celíacos expresan el heterodímero, cis o trans, del
HLA-DQ2 y el resto el heterodímero HLA-DQ8. Los pa-
cientes homozigotos para el HLA-DQ2 presentan al
menos cinco veces más riesgo de desarrollar la EC que
los heterocigotos
1,3
.

30
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
No obstante es necesario aclarar que la EC es una
enfermedad multigenética y, por lo tanto, la expresión
de HLA-DQ2/HLA-DQ8 es una condición necesaria
pero no suficiente para el desarrollo de la enfermedad.
Así del 30% al 40% de la población caucásica presenta
el HLA-DQ2 y sólo el 1% desarrolla EC. Diversos estu-
dios han cuantificado la especificidad de la combina-
ción de HLA-DQ2/HLA-DQ8 y ésta varía ampliamente
en función de la población estudiada del 12% al 68%
(media 54%)
3
.
Por lo tanto el estudio genético tiene un alto valor
predictivo negativo, de tal forma que la ausencia de
HLA-DQ2/HLA-DQ8 permite excluir la EC con un 99%
de certeza. Su utilización permitirá:
– Excluir del diagnóstico a otros miembros de la fa-
milia susceptibles de padecer la enfermedad,
– Estudiar a pacientes con alta sospecha clínica, se-
rología negativa y biopsia sólo con cambios infil-
trativos,
– Mejorar el diagnóstico de pacientes que rechazan
la realización de biopsia,
– Asesorar a aquellos que no tienen un diagnóstico
inicial correcto pero realizan una dieta sin gluten y
se plantea la reintroducción del mismo.
Anatomía patológica
La biopsia intestinal, pieza angular del diagnóstico
de enfermedad celíaca hasta ahora, sigue teniendo un
papel fundamental pero en casos seleccionados puede
no ser necesaria para el diagnóstico de certeza. En
este sentido se confiere al experto en gastroenterología
pediátrica el papel decisivo en la elección de las prue-
bas diagnósticas a realizar y la emisión de un diagnós-
tico de certeza.
En relación con la valoración anatomopatológica de
las muestras de mucosa intestinal obtenidas hay que
tener en cuenta algunos aspectos:
– La severidad de las lesiones es variable y es necesario
recordar que no son específicas de EC.
– La afectación de la mucosa intestinal puede ser
parcheada y a veces sólo afecta al bulbo duodenal.
Por lo tanto podemos obtener la muestra de una
zona sin lesión y establecer un diagnóstico erróneo.
Por este motivo la ESPGHAN recomienda tomar al
menos cinco biopsias: una del bulbo y cuatro de
entre la 2ª y 3ª porción duodenal.
– La valoración de la muestra de tejido obtenida
depende tanto de la preparación tras su obtención
como del especialista en anatomía patológica que la
estudia e interpreta.
– El informe anatomopatológico debe recoger: orien-
tación y grado de atrofia vellositaria, profundidad de
las criptas, relación vellosidad/cripta, número de
linfocitos intraepiteliales observados y establecer
el nivel de afectación por la clasificación de Marsh:
normal (0), infiltrativa (1), hiperplásica (2), atrofia
parcial (3a), atrofia subtotal (3b) y atrofia total (3c).
De esta forma se pretende evitar informes parciales
que puedan interpretarse erróneamente
1,3
.
Aproximación Diagnóstica
El estudio que la ESPGHAN recomienda realizar en
cada paciente varía en función del grupo de sospecha
diagnóstica en el que se encuentre
1
:
– Pacientes sintomáticos (Tabla I y Algoritmo 1): en
ellos debe solicitarse en primer lugar los anticuerpos
anti-TG2 de tipo IgA con obtención del nivel de IgA
total en suero. Los anti-DGP pueden usarse inicial-
mente o conjuntamente cuando otros anticuerpos
son negativos o el paciente es menor de dos años
de edad. Cuando existe deficiencia primaria o
secundaria de IgA deben determinarse los títulos de
anti-TG2, anti-DGP y/o EMA de tipo IgG.
Tabla I.: Pacientes con signos y síntomas
sugestivos de enfermedad celíaca
- Diarrea crónica o intermitente
- Fallo de medro
- Pérdida de peso
- Estancamiento ponderal
- Pubertad retrasada
- Amenorrea
- Anemia ferropénica
- Nauseas o vómitos persistentes
- Dolor abdominal crónico
- Distensión abdominal
- Estreñimiento crónico
- Fatiga crónica
- Aftas bucales recurrentes
- Dermatitis herpetiformes
- Fracturas óseas con traumatismos mínimos os-
teopenia/osteoporosis
- Alteración bioquímica hepática
» Si los anticuerpos son negativos en un paciente
con niveles adecuados de IgA y sin otras inmu-
nodeficiencias, ingesta de inmunosupresores y
adecuada ingesta de gluten es muy poco proba-
ble que los síntomas que presenta se deban a la
EC. No obstante en aquellos casos en los que
se exista una alta sospecha debe completarse el
estudio con la determinación de HLA DQ2/DQ8 y
obtención de biopsia intestinal.
» Si los anticuerpos son positivos debe remitirse al
especialista en gastroenterología pediátrica para
completar el diagnóstico. Éste valorará la determi-
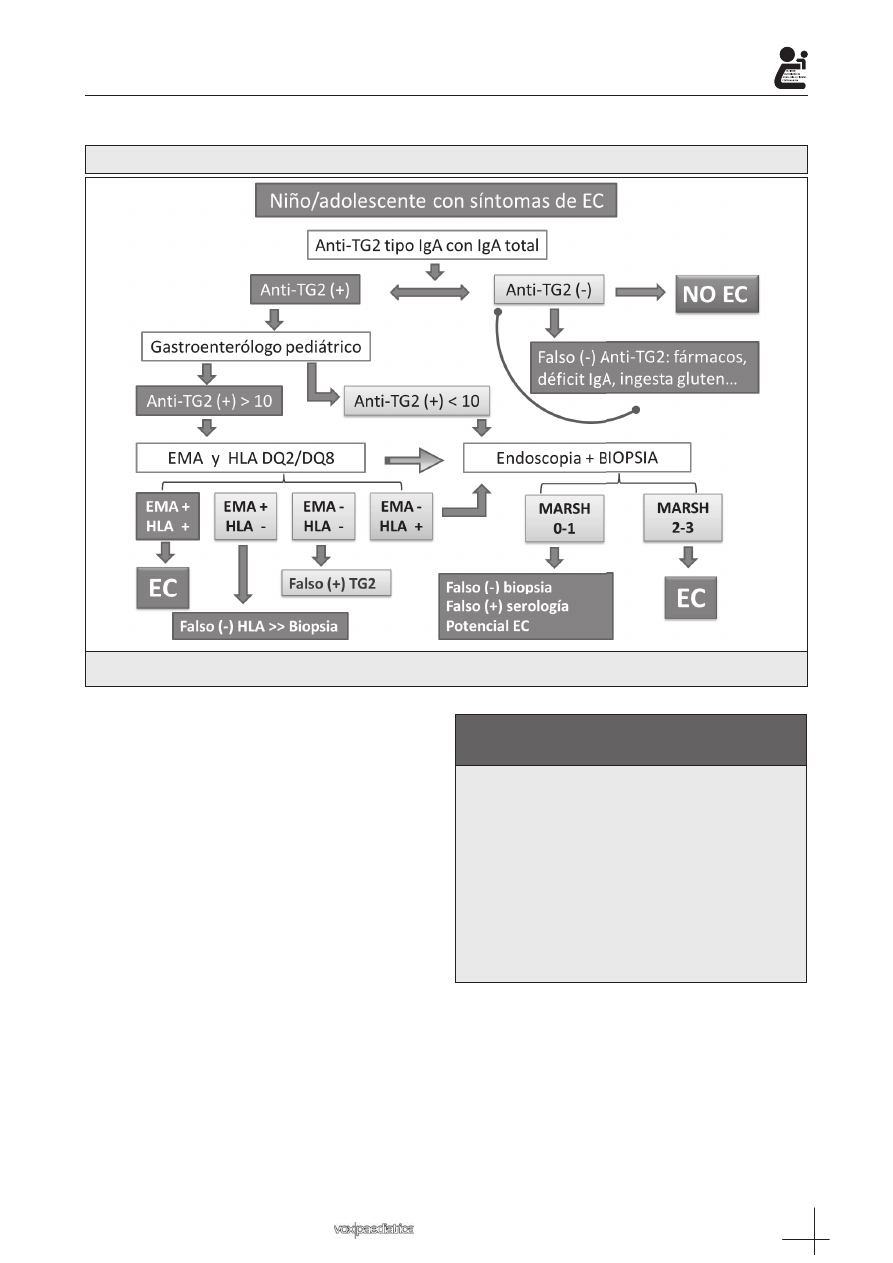
31
Volumen XIX Nº 2 Noviembre 2012
E
NFERMEDAD
C
ELÍACA
:
NUEVOS
CRITERIOS
DIAGNÓSTICOS
nación de títulos de EMA, estudio HLA DQ2/DQ8
y biopsia intestinal. En aquellos pacientes con sín-
tomas y signos compatibles con EC, niveles de ve-
ces anti-TG2 superiores en más de 10 los niveles
basales la correlación con atrofia vellositaria (March
3) es muy elevada. Así un reciente estudio esta-
blece que anti-TG2 superiores en más de 7 veces
los niveles de corte para ser considerado positivos
se correlacionan con atrofia vellositaria superior o
igual a March 2 en el 100% de los casos
5
. Por este
motivo el gastroenterólogo pediátrico puede de-
cidir completar el estudio, en estos casos selec-
cionados, con la determinación de EMA y estudio
HLA DQ2/DQ8 y obviar la biopsia intestinal si am-
bas pruebas apoyan el diagnóstico de EC.
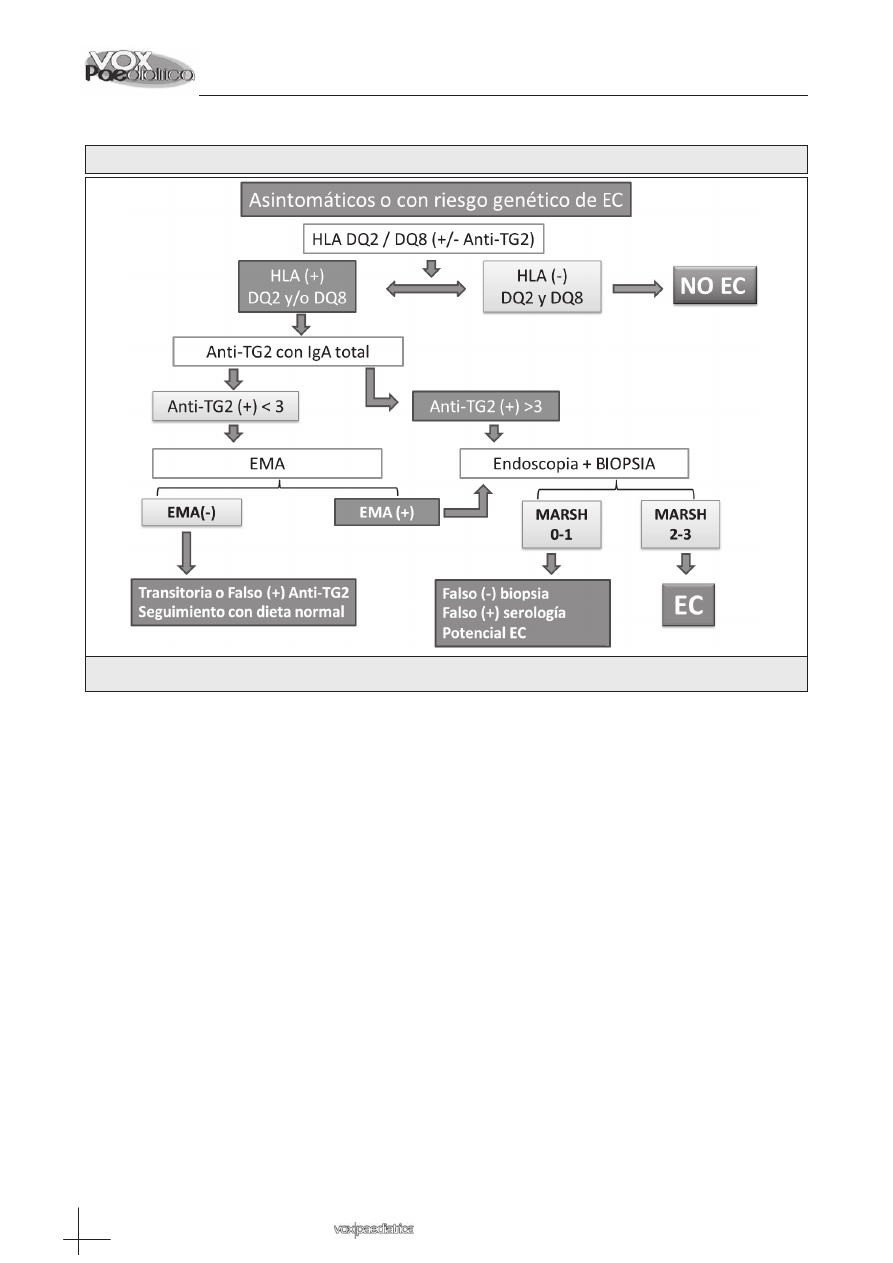
– Pacientes asintomáticos o pertenecientes a grupos
de riesgo (Tabla II y Algoritmo 2): en ellos debe
realizarse en primer lugar el estudio genético HLA
DQ2/DQ8.
» Si el estudio genético es negativo se puede ex-
cluir el diagnóstico de EC y no son necesarios
más estudios
» Si el estudio HLA DQ2/DQ8 es positivo, bien ho-
mozigoto bien heterocigoto, se debe determinar
los niveles de anti-TG2 y de IgA total para su va-
lidación.
Tabla II.: Pacientes asintomáticos o
pertenecientes a grupos de riesgo
- Diabetes mellitus tipo 1
- Síndrome de Down
- Enfermedad tiroidea autoinmune
- Síndrome de Turner
- Síndrome de Williams
- Déficit selectivo de inmunoglobulina tipo A
- Hepatitis autoinmune
- Familiares de primer grado con enfermedad ce-
líaca
- Si los niveles de anti-TG2 son negativos se de-
ben repetir a lo largo del seguimiento al menos
en otra ocasión.
- Si presenta niveles de anti-TG2 fluctuantes o in-
feriores en tres veces los basales debe realizarse
EMA y si estos son positivos obtener biopsia in-
testinal. Si los EMA son negativos es recomen-
dable el seguimiento clínico y serológico del pa-
ciente.
- Si los niveles de anti-TG2 son superiores en tres ve-
ces a los basales debe obtenerse biopsia intestinal.
Algoritmo diagnóstico 1: pacientes pediátricos con síntomas de enfermedad celíaca
EC: enfermedad celíaca; Anti-TG2: anticuerpos antitransglutaminasa tipo 2; IgA: inmunoglobulina tipo A; EMA:
anticuerpos antiendomisio; HLA: estudio genético HLA DQ2/DQ8; MARSH: clasificación de Marsh.
32
S
OCIEDAD
DE
P
EDIATRÍA
DE
A
NDALUCÍA
O
CCIDENTAL
Y
E
XTREMADURA
Volumen XIX Nº 2 Noviembre 2012
Formas Clínicas
Además de la EC típica o claramente definida por la
clínica y las pruebas diagnósticas se establecen los si-
guientes tipos
1
:
– Silente: pacientes con serología y estudio genético
HLA DQ2/DQ8 positivos, biopsia intestinal compa-
tible pero sin síntomas compatibles
– Latente: pacientes con estudio genético HLA DQ2/
DQ8 compatible pero sin enteropatía y que en
algún momento de su vida han presentado entero-
patía dependiente del consumo de gluten. Estos
pacientes pueden o no tener síntomas y/o serología
compatible.
– Potencial: pacientes con serología y estudio
genético HLA DQ2/DQ8 compatibles pero sin lesión
en la mucosa intestinal obtenida por biopsia. Estos
pacientes pueden tener o no síntomas y pueden o
no desarrollar enteropatía en un futuro.
Tratamiento
Una vez establecido el diagnóstico de certeza el ré-
gimen terapéutico consiste en una dieta estricta sin
gluten que deberá mantener a lo largo de la vida, con
lo que se consigue la desaparición de los síntomas clí-
nicos, de la alteración funcional y la normalización de la
mucosa intestinal. Además se evitan las posibles com-
plicaciones tardías derivadas del consumo de gluten en
un paciente celíaco. Se excluirá de la dieta cualquier
producto que contenga trigo, avena, cebada, centeno,
triticale y todos sus derivados
1,2,3
.
Se destacará la importancia al paciente y a su fami-
lia de que la ingesta de pequeñas cantidades de gluten
puede producir lesiones intestinales aunque no haya
repercusión clínica. En general se recomendará evitar el
consumo de productos en el que no se pueda compro-
bar el contenido en gluten. Los alimentos naturales, no
manufacturados y no pertenecientes a la familia de los
cereales, son seguros: frutas, hortalizas, carnes, pes-
cados, tubérculos, leche, huevos, etc. Es recomenda-
ble que la familia elabore un listado de productos ma-
nufacturados que no contengan gluten y que les per-
mita en cualquier circunstancia, viajes o compras sin el
listado de alimentos presente, adquirir o consumir sin
transgresión de la dieta
1,2
.
Seguimiento
El objetivo del seguimiento se basa en conocer la evo-
lución de los síntomas, asegurarnos del correcto cum-
plimiento de la dieta y del estado nutricional del niño.
Algoritmo 2: pacientes pediátricos asintomáticos o pertenecientes a grupos de riesgo
EC: enfermedad celíaca; Anti-TG2: anticuerpos antitransglutaminasa tipo 2; IgA: inmunoglobulina tipo A; EMA:
anticuerpos antiendomisio; HLA: estudio genético HLA DQ2/DQ8; MARSH: clasificación de Marsh.

33
Volumen XIX Nº 2 Noviembre 2012
E
NFERMEDAD
C
ELÍACA
:
NUEVOS
CRITERIOS
DIAGNÓSTICOS
Cuando la serología ha sido positiva, los controles se
realizarán con determinaciones de anti-TG2. Cuando la
clínica persiste, recidiva, o encontramos un nuevo au-
mento en el título de anticuerpos, la situación más fre-
cuente que hay que descartar es la presencia de trans-
gresiones mínimas de gluten
1,2
.
Generalmente al año de instaurar la dieta sin gluten
se produce, en la mayoría de los casos, la normaliza-
ción de los valores iniciales de anticuerpos. No es ne-
cesario, si el diagnóstico inicial era correcto y la evolu-
ción clínica y serológica normales, realizar nueva obten-
ción de biopsia digestiva
1
.
La provocación con gluten está indicada si existen
dudas sobre el correcto diagnóstico inicial, y debe rea-
lizarse previamente el estudio genético HLA DQ2/DQ8.
En caso de que éste sea negativo no está aconsejada
la toma de biopsia. Además no debe realizarse la pro-
vocación con gluten antes de los 5 años o durante la
adolescencia momento en el que debe preservarse el
incremento en la velocidad de crecimiento. El consumo
de gluten durante la provocación debe ser alrededor
de 15 gr/día. Si se produce un incremento en los títulos
de anticuerpos y expresividad clínica o histológica debe
considerarse como recaída y por lo tanto confirmación
diagnóstica de EC. Si por el contrario no se obtiene,
durante dos años de seguimiento, aumento de los títu-
los de anticuerpos o síntomas o cambios histológicos
compatibles debe considerarse la provocación fallida.
No obstante es recomendable el seguimiento clínico y
serológico de estos pacientes pues la recaída, aunque
improbable puede suceder más tarde
1,3
.
Comentario
Estos nuevos criterios diagnósticos de la ESPGHAN
para EC responden a las evidencias clínicas que mu-
chos gastroenterólogos pediátricos habían expresado
en numerosos trabajos. La correlación entre el nivel de
anticuerpos y lesión histológica o la posibilidad de uti-
lizar el estudio genético como herramienta diagnóstica
inicial quedan recogidos en dicho documento. No obs-
tante ha generado algunas dudas en cuanto al diag-
nóstico de certeza sin la realización de biopsia intestinal
en algunos supuestos. Es obvio que podría producirse
un aumento en el número de diagnósticos en niños que
realmente no son celiacos al no utilizarse con rigor las
recomendaciones diagnósticas. Es decir, sólo aquellos
pacientes sintomáticos con niveles de anti-TG2 supe-
riores en más de 10 los niveles basales, EMA positivos
y estudio genético compatible podrían beneficiarse de
un diagnóstico de certeza sin realización de biopsia in-
testinal. Esta posibilidad, en manos sólo del gastroen-
terólogo pediátrico, es sólo una opción diagnóstica que
no excluye la toma de biopsia intestinal si así lo consi-
dera el gastroenterólogo pediátrico en cada caso.
En este trabajo nos hemos centrado en los nuevos
criterios diagnósticos para la EC pero su conocimiento
abarca muchos más aspectos: dietéticos, evolutivos,
complicaciones, asociaciones con otras enfermeda-
des, etc., muchos de ellos recogidos en publicaciones
recientes
(6)
cuya lectura recomendamos.
Bibliografía
1. European Society for Pediatric Gastroenterology,
Hepatology, and Nutrition Guidelines for the Diag-
nosis of Coeliac Disease. S. Husby, S. Koletzko, I.R.
Korponay-Szabo, M.L. Mearin, A. Phillips, R. Shamir,
R. Troncone, K. Giersiepen, D. Branski, C. Catassi, M.
Lelgeman, M. Mäki, C. Ribes-Koninckx, A. Ventura,
and K.P. Zimmer, for the ESPGHAN Working Group
on Coeliac Disease Diagnosis, on behalf of the ESP-
GHAN Gastroenterology Committee. JPGN 2012;54:
136–160.
2. Diagnóstico precoz de la enfermedad celíaca.
SANIDAD 2008. MINISTERIO DE SANIDAD Y CON-
SUMO. NIPO: 351-08-086-X.
3. Update on celiac disease- etiology, differential
diagnosis, drug targets, and management advances.
S.A. Scanon, J.A Murray. Clin Exp Gastroenterol
2011;4:297-311.
4. Determination of IgG and IgA antibodies against
native gliadin is not helpful for the diangonsis of coeliac
disease in children up to 2 years old. Richter T, Bossuyt
X, Vermeersch P, Uhlig HH, Stern M, Hauer A, et al.
JPGN 2012;55:21-25
5. Correlation between IgA tissue transglutaminase
antibody ratio and Histological finding in Celiac Dis-
ease. Alessio MG, Tonutti E, Brusca I, Radice A, Licini
L, Sonzogni A, et al. JPGN 2012;55:44-49.
6. Enfermedad Celíaca. C. Coronel Rodríguez, M.C.
Guisado Rasco. Pediatr Integral 2011; XV(2): 109-125.
| Adjunto | Tamaño |
|---|---|
| voxpaed19.2pags28-33.pdf | 193.55 KB |



